PGC-1? — тренер митохондрий
|
Наши мышцы обладают удивительной способностью приспосабливаться к интенсивности работы, которую на них возлагают. Канадские ученые сделали очередной шаг в понимании механизма такой адаптации. Теперь мы знаем, что когда мы совершаем легкую утреннюю пробежку или катаемся на коньках, в наших мышцах небольшой белок PGC-1? перемещается из цитоплазмы в митохондрии, активируя гены, необходимые для обеспечения нас энергией.
Гиподинамия — один из факторов риска развития сердечнососудистых заболеваний, диабета 2-го типа, ожирения и гипертонии — заболеваний, которые получили широкое распространение в современном мире. Результаты клинических исследований показывают, что физическая активность (особенно выполнение упражнений на выносливость) снижает риск развития хронических заболеваний и продлевает жизнь. Оказалось, что это связано с балансом энергетического метаболизма. Как известно, за получение энергии в наших клетках отвечают митохондрии. При длительной физической нагрузке в клетках сердечной и скелетных мышц, мозга, печени и жировой ткани увеличивается количество митохондрий. Это хорошо известный феномен, и его молекулярные основы сейчас интенсивно изучаются.
Для создания и работы митохондрии требуется около 1500 различных белков. Хотя эти органеллы и обладают собственным геномом, часть необходимых белков закодирована в ядре. Следовательно, чтобы собрать митохондрию, необходимо координировать экспрессию ядерных и митохондриальных генов.
Регуляция экспрессии генов — работа белков, которые называются факторами транскрипции. Они могут связываться с регуляторными областями генов (промоторами), способствуя посадке на них фермента РНК-полимеразы, которая и синтезирует мРНК, по которой затем будет синтезирован белок.
Факторы транскрипции работают не в одиночку, им нужно множество белков-помощников. Один из них — PGC-1?. Известно, что при выполнении физических упражнений количество этого белка в клетке увеличивается, и он перемещается из цитоплазмы в ядро. PGC-1? запускает экспрессию ряда факторов транскрипции. Затем они активируют гены ядерного и митохондриального генома, необходимые для построения митохондрии.
Недавно выяснилось, что PGC-1? может проникать не только в ядро, но и в митохондрии, где он мог бы участвовать в активации генов митохондриального генома. У митохондрии есть специальный фактор транскрипции — Tfam, который активирует только гены митохондриального генома. До сих пор не известно никаких белков, которые бы помогали ему в этом процессе. Поэтому логично проверить, не окажется ли PGC-1? белком-коактиватором Tfam.
Исследователи из Канады, чья работа опубликована в недавно вышедшем номере Journal of Biological Chemistry, решили изучить роль транспорта PGC-1? в митохондрию при выполнении физической нагрузки.
Исследователи разделили мышей на три группы. Первая была контрольная (SED, от sedentary, «малоподвижный»), мыши из этой группы вели малоподвижный образ жизни — сидели в своих клетках. Мыши из второй (END, от endurance, «выносливость») и третьей (END+3) группы совершали интенсивную физическую работу — бегали по беговой дорожке со скоростью 15 м/мин. в течение 90 минут. К концу этого времени мыши были практически обессилены. Мыши из группы END сразу же отправлялись на экспериментальные процедуры, а мышам из группы END+3 давали перед этим 3 часа, чтобы восстановиться.
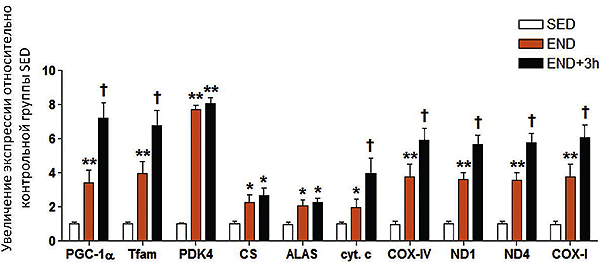
Оказалось, что у мышей в группах END и END+3 (то есть после нагрузки) повышена экспрессия митохондриальных и ядерных генов (рис. 2). Среди них были гены различных субъединиц НАДН-дегидрогеназы, цитратсинтазы, цитохрома с, а также некоторые другие. Общее для этих белков — то, что все они обеспечивают получение энергии в митохондриях.
Кроме того, увеличилась экспрессия митохондриального фактора транскрипции Tfam и коактиватора PGC-1?. Таким образом, при увеличении физической нагрузки мышцы стремятся приспособиться к возросшим энергетическим потребностям, увеличив количество ферментов, использующихся при получении энергии.
|
Чем обусловлено такое усиление экспрессии? Не может ли в этом процессе принимать участие PGC-1?? Исследовав количество этого белка до (мыши группы SED) и после (мыши группы END и END+3) нагрузки, ученые пришли к выводу, что его количество во время нагрузки не меняется. Это неудивительно, несмотря на то, что количество мРНК для белка увеличилось. Такой механизм, когда мРНК запасается в клетке до определенного момента, хорошо известен.
Значит, если PGC-1? и участвует в изменении экспрессии, то каким-то другим способом. Например, общее количество белка в клетке может не меняться, но он может просто перераспределяться между разными частями клетки. Ранее уже было показано, что PGC-1? обнаруживается в митохондриях, но какую роль он там играет, было неясно.
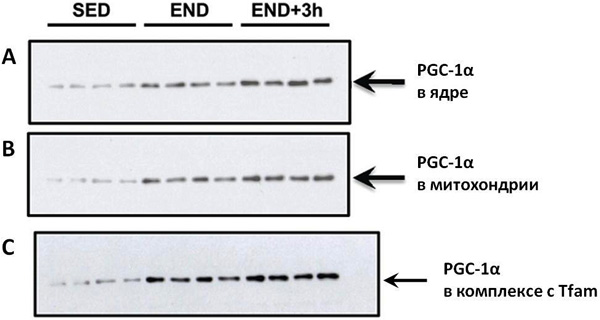
Поэтому ученые проверили содержание белка в митохондриях и в ядрах у мышей из разных групп (рис. 3). Оказалось, что количество белка в этих органеллах существенно увеличивается сразу после нагрузки (группа END), а также продолжает расти после нее (группа END+3). Следовательно, миграция PGC-1? в ядро и в митохондрии может быть причиной активации генов в ответ на физическую нагрузку.
Однако сам по себе PGC-1? — не фактор транскрипции, а его помощник. Известно, что у митохондрии есть свой собственный фактор транскрипции Tfam. Ученые предположили, что PGC-1? может связываться с Tfam и таким образом участвовать в активации экспрессии генов митохондрии. Оказалось, что в клетках мышей из группы END и END+3 количество белка PGC-1?, взаимодействующего с Tfam, увеличивается. Следовательно, PGC-1? может взаимодействовать с фактором транскрипции Tfam, усиливая его активность.
|
В итоге складывается следующая картина. Когда клетки мышц заняты длительной физической работой, их энергетические потребности увеличиваются. Клетки пытаются приспособиться к новым условиям. Для этого им необходимо увеличить количество митохондрий или количество ферментов, обеспечивающих синтез АТФ в уже существующих митохондриях. Следовательно, необходимо активировать экспрессию генов, причем как в ядре, так и в митохондриях. Поэтому PGC-1? перемещается в ядро и в митохондрии, где помогает факторам транскрипции активировать работу генов. Таким образом, PGC-1? является частью механизма, помогающего мышцам адаптироваться к длительным нагрузкам.
Какова природа сигналов, заставляющих PGC-1? перемещаться в митохондрию и ядро? Ученые предполагают, что это, во-первых, какая-либо модификация белка. Например, фосфорилирование под действием клеточных киназ. Сами эти киназы могут активироваться активными формами кислорода. А, как известно, при интенсивной работе увеличивается скорость дыхания митохондрий, что приводит к увеличению количества активных форм кислорода.
Еще один вопрос связан с механизмом проникновения PGC-1? в митохондрию. Через ее мембраны могут проходить белки, имеющие специальную сигнальную последовательность. В PGC-1? ее обнаружено не было. Однако, возможно, PGC-1? может цепляться к белкам, у которых такой сигнал есть, и таким образом проникать в органеллу.
Все эти вопросы имеют не только чисто научное значение. Сегодня PGC-1? рассматривается как одна из мишеней для лечения заболеваний, связанных с митохондриями. Например, небольшое увеличение экспрессии PGC-1? в мышцах приводит к ослаблению атрофии, облегчает течение мышечной дистрофии Дюшенна, болезни Паркинсона и Хантингтона. Кроме того, PGC-1? способствует сохранению нервно-мышечных синапсов, снижению жировых отложений и воспаления, помогает поддерживать в норме уровень глюкозы и инсулина в крови. Следовательно, нарушение локализации PGC-1? может быть связано со всеми подобными патологиями.
В будущем, когда для лечения болезней будет опробована генная терапия с использованием PGC-1?, возникнет проблема его правильной локализации. И тогда, возможно, именно физические упражнения могут быть единственным и достаточно безопасным способом достигнуть этого эффекта.
Источник: Adeel Safdar, Jonathan P. Little, Andrew J. Stokl, Bart P. Hettinga, Mahmood Akhtar, Mark A. Tarnopolsky. Exercise Increases Mitochondrial PGC-1? Content and Promotes Nuclear-Mitochondrial Cross-talk to Coordinate Mitochondrial Biogenesis // Journal of Biological Chemistry. 2011. V. 286 (12). P. 10605–10617.
Дмитрий Кирюхин