В долгосрочном эволюционном эксперименте выявлен отбор на «эволюционную перспективность»
|
В ходе долгосрочного эволюционного эксперимента на бактериях E. coli показана способность естественного отбора поддерживать мутации, которые не дают максимального выигрыша «здесь и сейчас», но обеспечивают наилучшие возможности для дальнейшей эволюции. Выяснилось, что мутации с сильным положительным эффектом, обеспечивающие быстрое достижение репродуктивного преимущества, могут снижать эволюционный потенциал, делая последующие мутации менее выгодными. В итоге окончательная «победа» в эволюционном соревновании может достаться организмам, которые поначалу проигрывали своим конкурентам. Открытие перекликается с палеонтологическими данными, согласно которым медленное развитие сбалансированных комплексных адаптаций в долгосрочной перспективе оказывается более «выигрышным», чем быстрое развитие эффективных, но односторонних приспособлений.
«Элементы» уже рассказывали об уникальном эволюционном эксперименте с бактерией Escherichia coli (кишечной палочкой), начатом в 1988 году американскими исследователями под руководством Ричарда Ленски (Richard Lenski); см.: Подведены итоги эволюционного эксперимента длиной в 40 000 поколений («Элементы», 02.11.2009). Одним из многочисленных достоинств этого эксперимента является то, что часть эволюционирующих бактерий периодически замораживают и сохраняют в таком виде для дальнейших исследований. Заморозка не вредит здоровью микробов: в любой момент их можно оживить и использовать в опытах. Это открывает потрясающие возможности. Например, можно напрямую сравнивать приспособленность (= скорость роста) ныне живущих бактерий, которые уже более 50 000 поколений эволюционируют в своих колбах под присмотром ученых, с их далекими предками. Кроме того, любое эволюционное событие, зарегистрированное в ходе эксперимента, можно многократно «проигрывать заново», размораживая соответствующих предков и наблюдая, произойдет ли у них это событие снова. Это позволяет отделять случайные и маловероятные события от закономерных и высоковероятных.
В последнем номере журнала Science Ленски и его коллеги сообщили о новом интересном результате, который они получили, «проигрывая заново» эволюцию нескольких линий подопытных бактерий, замороженных по прошествии 500 поколений основного эксперимента. К этому времени в популяции уже появилось несколько полезных мутаций, которые впоследствии достигнут стопроцентной частоты. Кроме того, на этом этапе эксперимента, как и на любом другом, в популяции присутствовали обладатели разных менее удачных мутаций, которые впоследствии будут вытеснены. Подопытные бактерии лишены генов, позволяющих обмениваться наследственным материалом (популяция является «бесполой»), поэтому полезные мутации, возникшие у разных микробов, не могут объединяться и комбинироваться. Это позволило авторам выделить среди замороженных микробов поколения №500 «будущих победителей» (eventual winners, EW) — бактерий, обладающих мутациями, которые впоследствии достигли стопроцентной частоты в популяции, и «будущих проигравших» (eventual losers, EL) — тех, чьи потомки впоследствии исчезли из популяции. Исследовали по два штамма каждого типа, то есть всего четыре линии, выведенные из двух бактерий EW и двух бактерий EL.
Размороженные «будущие победители» (EW) имели полезные мутации в генах topA и rbs. Первый ген кодирует фермент топоизомеразу (см. topoisomerase), который помогает расплетать и снова сплетать двойную спираль ДНК в ходе транскрипции (считывания генетической информации). От свойств топоизомеразы зависит активность множества генов. Второй ген, rbs — это даже не ген, а целый оперон (группа близко расположенных генов, которые регулируются и «читаются» все вместе), отвечающий за усвоение рибозы.
Мутация topA, характерная для «победителей», влияет на активность многих генов и сама по себе дает 13-процентный выигрыш в приспособленности по сравнению с исходным, предковым штаммом бактерий, с которого начался эксперимент. Это было установлено при помощи генно-инженерных опытов: предку «пересадили» эту мутацию, не меняя остального генома, и сравнили конкурентоспособность модифицированного штамма с исходным. Все мутации в опероне rbs, поддержанные отбором в ходе эксперимента, представляют собой делеции (выпадения участков ДНК), дающие выигрыш в 1–2%. В ходе эксперимента бактерий кормили чистой глюкозой, а не рибозой, поэтому потеря части рибозного оперона могла быть выгодна, поскольку снижала расходы клетки на синтез лишних белков.
У одного из двух штаммов «будущих проигравших» (EL) не было никаких полезных мутаций, известных исследователям (здесь необходимо учитывать, что ученым удалось пока идентифицировать далеко не все мутации, возникавшие и поддерживавшиеся отбором в ходе долгосрочного эксперимента), а у второго была мутация в опероне rbs, но не такая, как у «победителей». Впоследствии выяснилось, что у обоих штаммов EL была также мутация в гене topA, ранее не известная и отличная от той, что была у «победителей». Авторы обозначили ее topA1. Она тоже полезна сама по себе, но повышает приспособленность не на 13, а только на 5%.
Для начала авторы сравнили приспособленность (скорость роста) штаммов EW и EL. Казалось бы, у первых приспособленность должна быть выше. Ведь у них есть полезные мутации, которые впоследствии закрепились (достигли 100-процентной частоты), тогда как у EL этих мутаций нет. Кроме того, известно, что потомки EW в конечном счете победили в эволюционном соревновании потомков EL.
Как ни странно, результат оказался противоположным. Выяснилось, что штаммы EL превосходят по приспособленности исходный предковый штамм на 20–23%, тогда как EW опережают предка лишь на 13–15%. Таким образом, после 500 поколений эволюции в условиях эксперимента «будущие проигравшие» сильно опережали по приспособленности «будущих победителей». Это, конечно же, означает, что у EL имеются какие-то полезные мутации, которые ученым пока не удалось идентифицировать, причем полезный эффект этих мутаций перекрывает пользу, приносимую известными мутациями topA и rbs.
Авторы рассчитали, что если бы репродуктивное преимущество EL над EW, наблюдавшееся после 500-го поколения, сохранялось и впредь, то EL должны были бы полностью вытеснить EW примерно за 350 поколений, то есть к 850-му поколению. Как мы знаем, этого не случилось. Произошло обратное: потомки EW вытеснили потомков EL. Очевидно, потомкам EW удалось менее чем за 350 поколений приобрести новые полезные мутации, которые позволили им обогнать потомков EL в эволюционном соревновании. Естественно, возникает вопрос: почему потомки EL сами не приобрели аналогичных мутаций, ведь у них было на это ровно столько же времени?
Авторы предположили, что разгадка может скрываться в различном влиянии мутаций, имеющихся у EW и EL, на дальнейшие эволюционные перспективы. Эффекты мутаций могут влиять друг на друга; это явление называют «эпистазом» (см.: epistasis; Расширение белковой вселенной продолжается, «Элементы», 24.05.2010). Степень «полезности» той или иной мутации не абсолютна: она зависит от генетического контекста. Скажем, мутация А может быть полезной при наличии мутации Б, но вредной при ее отсутствии (или наоборот). Можно предположить, что полезные мутации, обеспечившие быстрый рост приспособленности у EL в течение первых 500 поколений, снизили способность бактерий к дальнейшей адаптивной эволюции. Например, они могли сделать менее полезными или даже вредными какие-то другие, еще не возникшие мутации, полезные в других генетических контекстах. Поэтому потомки EL, у которых возникали такие мутации, не поддерживались (или отсеивались) отбором. При этом те мутации, которые в первые 500 поколений закрепились у EW, сами по себе были менее полезны, но зато они не закрыли дорогу для приобретения других полезных мутаций.
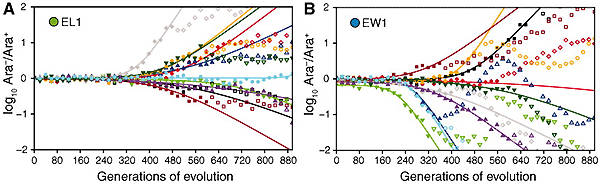
Для проверки этого предположения авторы поставили несколько остроумных экспериментов. В первом из них выяснялось, насколько полезной в среднем будет первая полезная мутация, возникшая в ходе эволюции у потомков штаммов EW и EL. Для этого в геномы бактерий каждого из четырех штаммов внесли точечные мутации, меняющие состояние гена Ara, ответственного за расщепление сахара арабинозы. В результате в пределах каждого штамма были получены формы, способные и не способные расщеплять арабинозу (Ara+ и Ara–). Это удобный фенотипический маркёр, давно применяемый авторами в ходе долгосрочного эволюционного эксперимента. Бактерий Ara+ и Ara– легко отличить друг от друга, добавив в среду арабинозу и специальный краситель: колонии бактерий Ara– при этом становятся красными, Ara+ — белыми. Состояние гена Ara не влияет на приспособленность бактерий в условиях эксперимента.
Бактерий Ara+ и Ara– из одного и того же штамма (EW1, EW2, EL1 или EL2) смешивали в соотношении 50:50 и позволяли эволюционировать в тех же условиях, что и в основном эксперименте. При этом в каждом поколении определялось соотношение бактерий Ara+ и Ara–. До тех пор, пока в эволюционирующей популяции не возникало никаких полезных мутаций, это соотношение оставалось близким к 50:50 (происходили лишь небольшие случайные колебания этой величины). Но как только возникала первая полезная мутация, ситуация резко менялась. Фокус тут в том, что любая полезная мутация изначально возникает у какой-то одной бактерии. Либо «повезет» бактерии Ara+, либо Ara–. Потомки бактерии с полезной мутацией начинают быстро размножаться, и, соответственно, в популяции начинает расти доля либо белых, либо красных микробов (точнее, микробов, образующих белые или красные колонии на соответствующей среде). При этом ученые получают сразу две уникальные возможности: 1) с большой точностью поймать момент возникновения первой полезной мутации, 2) оценить степень ее полезности по скорости, с которой соотношение Ara+/Ara– будет отклоняться от исходного.
Нужно подчеркнуть, что речь здесь идет только о первой полезной мутации. Пока полезная мутация, поддерживаемая отбором, всего одна, соотношение Ara+/Ara– уходит от исходного состояния (50:50) по экспоненте, и всю ситуацию можно анализировать при помощи достаточно простой математики. Как только появляется вторая полезная мутация, картина сразу меняется и становится слишком сложной для анализа.
Для каждого из четырех штаммов эволюционный эксперимент «прокрутили» 10 раз, получив, таким образом, в общей сложности 40 графиков изменения соотношения Ara+/Ara– во времени. Заодно авторы получили 40 подопытных линий вместо исходных четырех.
При помощи этой великолепной методики авторы показали, что скорость (вероятность) появления полезных мутаций в линиях EW и EL одинакова, однако средняя полезность первой полезной мутации, возникающей в штаммах EW, заметно выше, чем у EL. Иными словами, экспоненциальный рост или снижение соотношения Ara+/Ara– у EW в среднем происходили быстрее, чем у EL, вплоть до появления второй полезной мутации, которая «смазывала» картину. У EW первая полезная мутация повышала приспособленность в среднем на 6%, а у EL — только на 4%. Это подтверждает предположение о том, что «генетический контекст» у штаммов EW более благоприятен для последующей адаптивной эволюции, чем у штаммов EL. Разумеется, полезные мутации, возникавшие в ходе этих 40 опытов, были разными, и далеко не во всех случаях авторам удалось их идентифицировать.
|
Однако после приобретения одной новой полезной мутации штаммы EW всё-таки еще оставались в среднем менее приспособленными, чем штаммы EL, хотя разрыв между ними и сократился (от 6,3% до 4,5%).
Чтобы понять, насколько закономерной была итоговая «победа» EW в исходном эксперименте, авторы позволили всем 40 линиям, полученным в ходе предыдущего опыта, эволюционировать в течение 883 поколений. После этого их приспособленность сравнили в прямых конкурентных экспериментах. Выяснилось, что EW теперь в среднем на 2,1% более приспособлены, чем EL. Это значит, что их победа была не случайностью, а закономерным следствием более высокого «эволюционного потенциала». Правда, авторы подчеркивают, что этот вывод не абсолютен: он имеет статистический характер. Не все потомки EW после 883 поколений оказались более приспособленными к экспериментальным условиям, чем любой из потомков EL. Речь идет, разумеется, о среднестатистических результатах.
Авторам удалось расшифровать один конкретный пример взаимного влияния мутаций (эпистаза), который, по-видимому, обеспечил итоговый выигрыш EW. Оказалось, что в 6 из 20 линий потомков EW за 883 поколения закрепились полезные мутации в гене spoT — многофункциональном регуляторе активности генов. Мутация в этом гене закрепилась также и в основном долгосрочном эксперименте. Однако ни в одной из 20 линий потомков EL мутации в гене spoT не зафиксировались. При помощи генно-инженерных экспериментов удалось показать, что мутация spoT, закрепившаяся в основном эксперименте, оказывается полезной в сочетании с мутацией topA, характерной для штаммов EW, но не приносит никакой пользы в сочетании с мутацией topA1, характерной для EL.
Получается, что тот эволюционный путь, по которому пошли бактерии EL, хотя и обеспечил им преимущество на ранних этапах эксперимента, оказался менее перспективным — в частности, потому, что лишил бактерий возможности повысить свою приспособленность за счет приобретения мутаций в гене spoT.
Таким образом, авторам удалось показать, что в долгосрочной перспективе вероятность закрепления в популяции той или иной мутации может зависеть не только от непосредственного влияния этой мутации на приспособленность «здесь и сейчас», но и от ее воздействия на эволюционные перспективы, то есть на вероятность того, что какие-то другие мутации, которые могут возникнуть в будущем, окажутся полезными. В результате линии, поначалу вырвавшиеся вперед в эволюционной «гонке», в конечном счете могут оказаться в проигрыше. Разумеется, для этого необходимо, чтобы отстающие, но перспективные линии успели приобрести дополнительные полезные мутации раньше, чем их полностью вытеснят более успешные конкуренты.
Полученные результаты перекликаются с закономерностью, которую подметил еще в XIX веке палеонтолог В. О. Ковалевский, изучавший эволюцию копытных (см.: инадаптация). Палеонтологическая летопись демонстрирует немало примеров того, как из двух конкурирующих групп, возникших примерно в одно и то же время, сначала добивается успеха одна, но затем ее вытесняет другая. При этом адаптивная эволюция в обеих группах идет в одном том же направлении. В той группе, которая первой добивается успеха, ключевые приспособления (у копытных речь идет прежде всего о строении скелета стопы и кисти) развиваются быстрее, но выглядят более «односторонними», поверхностными, несбалансированными. Во второй группе, которая поначалу занимает подчиненное положение, аналогичные адаптации развиваются медленнее, но в итоге оказываются более «комплексными», сбалансированными и глубокими (см.: А. П. Расницын. Инадаптация и эвадаптация). Эту закономерность традиционно объясняли на основе общих представлений о «компромиссном» характере эволюции. Любая адаптация покупается ценой ограничения возможностей для развития каких-то других адаптаций. Быстро приобретенные «косметические» адаптации могут перекрыть пути дальнейшего совершенствования, так что весь путь в итоге оказывается тупиковым. Теперь мы видим, как эта закономерность может работать на молекулярно-генетическом уровне.
Источник: Robert J. Woods, Jeffrey E. Barrick, Tim F. Cooper, Utpala Shrestha, Mark R. Kauth, Richard E. Lenski. Second-Order Selection for Evolvability in a Large Escherichia coli Population // Science. 2011. V. 331. P. 1433–1436.