Проясняется механизм формирования синапсов
|
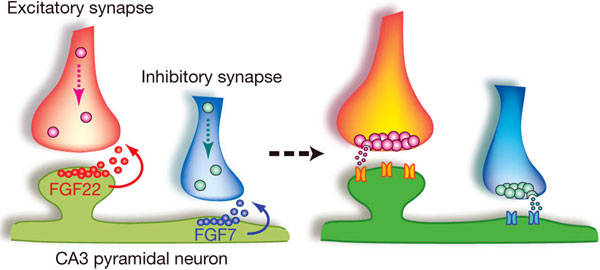
Правильный баланс между глутаматными (возбудительными) и ГАМК-овыми (тормозными) синапсами — одно из необходимых условий для правильной работы мозга. Нарушение этого баланса может стать причиной целого веера заболеваний — от эпилепсии до синдрома Туретта. Но каковы механизмы, благодаря которым между двумя данными нейронами образуется синапс нужного типа, до сих пор оставалось загадкой. И постепенно эта загадка разгадывается: выяснилось, что два фактора роста фибробластов — FGF22 и FGF7 — способствуют формированию возбудительных и тормозных синапсов соответственно.
|
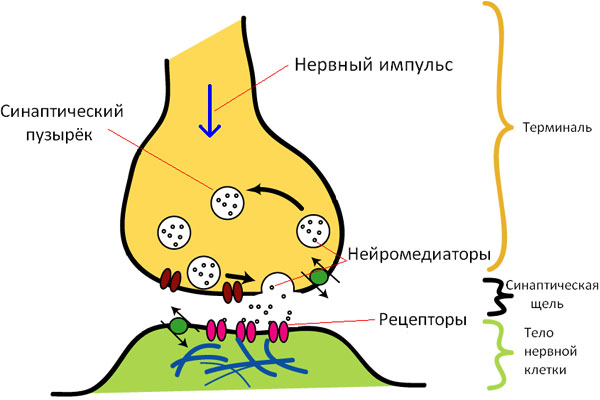
Синапс — это контакт между двумя нейронами (или между нейроном и эффекторной клеткой). Когда в синапс приходит импульс, синаптические пузырьки (их еще называют везикулами) «выплевывают» содержащиеся в них нейромедиаторы в синаптическую щель; эти медиаторы «садятся» на соответствующие рецепторы постсинаптической мембраны. Активация рецепторов вызывает изменение трансмембранных ионных токов, и, в зависимости от медиатора и рецептора, окрестный участок мембраны либо деполяризуется (тогда мы имеем дело с возбудительным постсинаптическим потенциалом, ВПСП), либо гиперполяризуется (тогда перед нами тормозный постсинаптический потенциал, ТПСП).
При возникновении синапса в образующих его участках нейронов происходит множество изменений. Например, в пресинаптической части перестраивается цитоскелет, появляются скопления синаптических везикул и возникает механизм их оборота и так далее. Само собой, эти изменения не могут происходить просто так, в их основе лежат какие-то молекулярные механизмы. Однако сейчас об этих механизмах почти ничего не известно. Есть только несколько «путеводных ниточек» — например, недавно было показано, что члены большого семейства белков — факторов роста фибробластов (см. Fibroblast growth factor) — FGF22, FGF7 и FGF10 способствуют образованию нервно-мышечных соединений, а также синапсов в мозжечке.
Однако что именно делают эти белки во время синаптогенеза, до сих пор было неясно. Группа исследователей из Мичиганского университета решила разобраться в этом вопросе.
В фокусе внимания исследователей оказалась область CA3 гиппокампа. Там высок уровень матричных РНК, кодирующих FGF22 и FGF7, а раз наши белки в данном регионе присутствуют, они здесь явно для чего-то нужны.
Если белок выполняет какую-нибудь заметную функцию, то проще всего узнать его роль, просто «выключив» его и посмотрев, какие изменения произойдут с организмом. Поэтому для экспериментов использовались мыши, нокаутные по генам FGF22 и FGF7 (то есть лишенные данных белков); линии этих мышей назывались FGF22KO и FGF7KO соответственно.
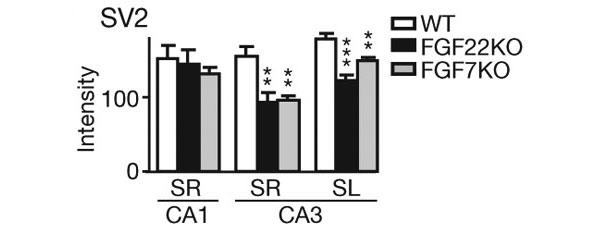
Никаких заметных анатомических изменений в гиппокампе у нокаутных мышей замечено не было. Однако кластеризация белка синаптических везикул SV2 в регионе CA3 у обеих линий нокаутов была серьезно нарушена. Это означает, что оба наши белка имеют какое-то отношение к образованию везикул — пузырьков с нейромедиатором, выбрасываемых в синаптическую щель во время передачи сигнала. Причем, что интересно, в близком регионе CA1 никаких проблем с тем же белком SV2 не было — значит, в синапсах CA1 наши белки не работают.
|
Еще интереснее то, что дефект в кластеризации синаптических везикул и у FGF22KO, и у FGF7KO был неполным. Это выглядело так, как будто каждый из этих белков помогает сформироваться не всем синапсам данной области, а только части из них, поэтому и «выключение» одного из белков не «выключает» все синапсы вместе.
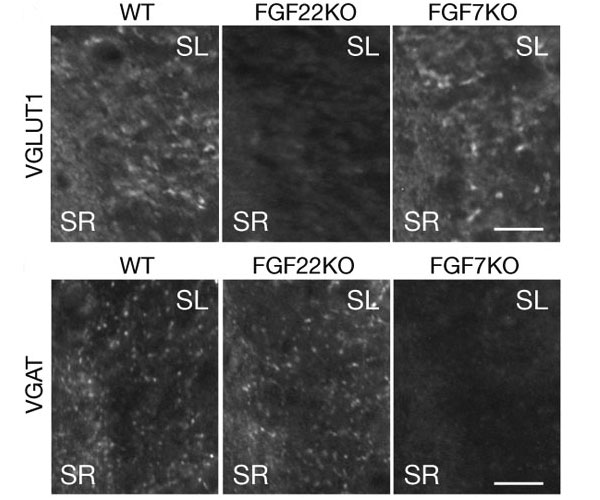
Однако по какому же признаку каждый из этих белков выбирает «свои» синапсы? Ученые предположили, что один из них «заведует» возбудительными глутаматными, а другой — тормозными ГАМК-овыми синапсами (ГАМК — гамма-аминомасляная кислота). И действительно, оказалось, что кластеризация везикул в глутаматных синапсах понижена у FGF22KO и находится на нормальном уровне у FGF7KO, а ГАМК-овые везикулы хуже кластеризуются у FGF7KO, а у FGF22KO, наоборот, в порядке. В то же время постсинаптическая часть что у глутаматных, что у ГАМК-овых синапсов, судя по всему, не нарушена. Всё это свидетельствовало о том, что FGF22 «помогает» возникнуть пресинаптической части глутаматных синапсов, а FGF7 — ГАМК-овых, в то время как к постсинаптической части эти белки, видимо, не имеют отношения.
Эта догадка подтвердилась, когда ученые решили сравнить ультраструктуру возбудительных и тормозных синапсов у FGF22KO, FGF7KO и мышей дикого типа. Оказалось, что в возбудительных синапсах у FGF22KO везикулы мельче и более рассредоточены, чем у мышей дикого типа. У FGF7KO не было такой проблемы в возбудительных синапсах, зато она возникала в тормозных. Результаты этого эксперимента, а также целой серии дополнительных опытов, подтвердили, что FGF22 помогает сформироваться глутаматным синапсам, а FGF7 — ГАМК-овым.
|
Хорошо, но почему же эти белки действуют по-разному? Судя по всему, дело обстоит так. FGF7 способен связываться только с одним рецептором — FGFR2b, а FGF22 — сразу с двумя: FGFR2b и FGFR1b (хотя FGFR1b он, похоже, «любит» больше). «Включение» разных рецепторов вызывает различные каскады реакций, которые приводят к формированию разных везикул; это, видимо, и влечет за собой образование различных типов синапсов. А поскольку, как удалось доказать исследователям, FGF7 и FGF22 локализуются в нейронах в различных и неперекрывающихся областях, то «конкуренции» по поводу того, какой именно синапс появится в данном месте, не возникает. Да, стоит отметить одну важную деталь. Оба белка обнаруживаются в дендритах, то есть в постсинаптической части синапса. Это значит, что постсинаптическая часть «дирижирует» образованием пресинаптической части.
|
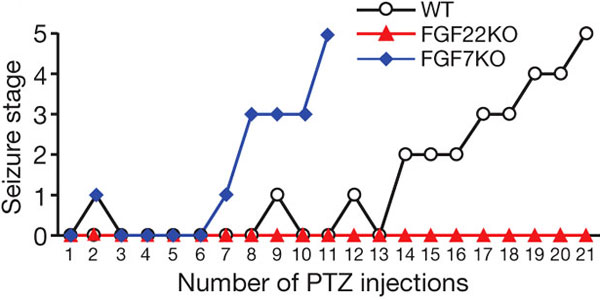
Более или менее разобравшись с «вечными вопросами» (что это такое и как это работает), ученые попробовали понять, как связана работа исследованных белков с работой целого мозга. Дело в том, что некоторые болезни, например эпилепсия, могут быть вызваны неправильным балансом между возбудительными и тормозными синапсами в гиппокампе. А поскольку наши белки занимаются именно созданием правильного баланса, то вполне возможно, они как-то связаны с проявлением эпилепсии. Исследователи решили проверить это довольно простым способом — подвергли нокаутных по нашим белкам мышей киндлингу (см. Kindling), то есть вызвали у них искусственные эпилептические припадки. Оказалось, что FGF7KO-мыши гораздо сильнее подвержены припадкам, чем мыши дикого типа, зато у FGF22KO за весь период исследования не было припадков вовсе. Всё это может означать, что наши белки имеют к возникновению эпилепсии прямое отношение и, больше того, что открываются новые пути для борьбы с этой болезнью.
Источник: Akiko Terauchi, Erin M. Johnson-Venkatesh, Anna B. Toth, Danish Javed, Michael A. Sutton, Hisashi Umemori. Distinct FGFs promote differentiation of excitatory and inhibitory synapses. // Nature 465, 783–787 (10 June 2010).
Вера Башмакова