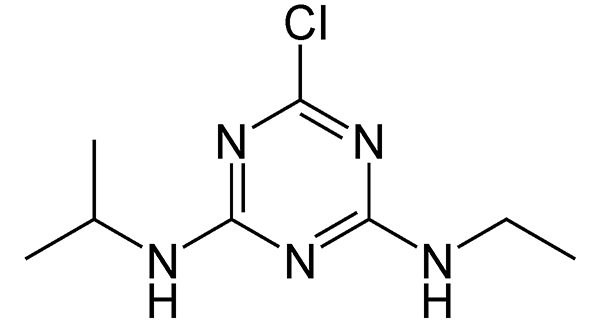
Клетки кишечной палочки смогли найти и уничтожить гербицид атразин
|
Мечта каждого ученого, занимающегося синтетической биологией, — перепрограммировать клетки так, чтобы они могли самостоятельно выполнять сложные задания — например, синтезировать или, наоборот, расщеплять какие-то вещества. Постепенно эта мечта начинает сбываться: недавно были созданы мутантные клетки кишечной палочки (Escherichia coli), которые распознают гербицид атразин, передвигаются к месту его локализации и уничтожают его.
Поскольку атразин не имеет никакого отношения к жизнедеятельности кишечной палочки, работа состояла из двух частей. Во-первых, надо было «научить» бактерии распознавать атразин и двигаться в его сторону (такое перемещение называется псевдотаксисом, по аналогии с хемотаксисом). Во-вторых, бактерии должны были получить «оружие для уничтожения» гербицида (то есть расщепляющие его ферменты).
У кишечной палочки есть целая система белковых сенсоров для определения различных химических веществ — аминокислот, дипептидов и сахаров. В принципе, можно было попробовать «переделать» один из сенсоров так, чтобы он реагировал на атразин, однако исследователи решили пойти другим путем и «натаскать» на этот гербицид не белки, а молекулы РНК.
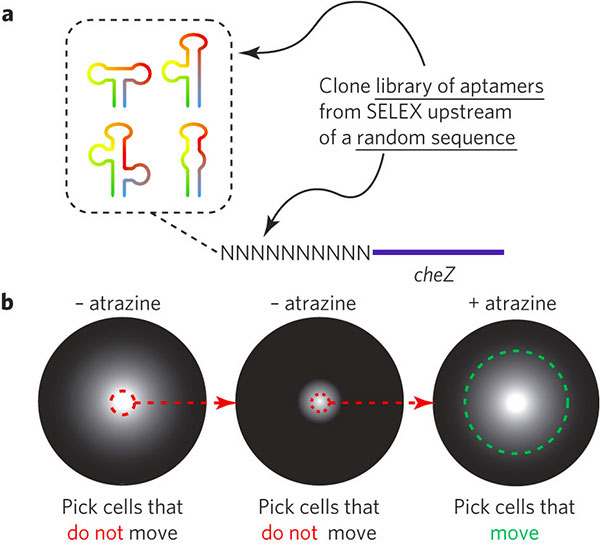
Для этого была использована технология SELEX. Эта селекционная методика выбирает из гигантских (более 1014 членов) библиотек те последовательности РНК, которые специфически и прочно связываются с необходимым лигандом (такие РНК-, ДНК- или белковые последовательности называются аптамерами; см. Aptamer). На основе полученного аптамера создаются рибопереключатели — РНК-последовательности, которые лиганд-зависимо регулируют экспрессию генов без помощи белковых кофакторов. Дальше возникает множество вариантов: можно заставить клетки включить в свой метаболизм чуждое для них вещество, научить их передвигаться в сторону неких молекул или, наоборот, «удирать» от них, и так далее.
К сожалению, часто бывает так, что рибопереключатель, полученный на основе аптамера с высоким сродством к лиганду, по какой-то причине оказывается «нерабочим» и не может вызвать необходимые реакции в клетке. Предсказать «компетентность» аптамера в этом вопросе довольно трудно. Поэтому исследователи предпочли получить большую библиотеку аптамеров со средним сродством к атразину вместо того, чтобы искать один аптамер с высоким сродством.
Дальше — дело техники. На основе каждого члена этой библиотеки создаем рибопереключатель и «пришиваем» его к какому-нибудь заметному гену (в исследовании использовался ген cheZ, отвечающий за подвижность клеток E. coli и вовлеченный в процесс хемотаксиса у этой бактерии). Трансформируем дефицитные по cheZ (то есть лишенные этого гена и неспособные двигаться) клетки кишечной палочки с помощью полученной библиотеки рибопереключателей и рассеваем их на среду без атразина. Если рибопереключатель работает, то в отсутствие атразина клетки двигаться не смогут; поэтому из всех бактериальных клонов мы выбираем только неподвижные. После двух циклов такой селекции начинается второй этап — выбранные клоны рассеваем на среду с атразином. Теперь признаком работающего рибопереключателя, наоборот, стала подвижность клеток.
|
В результате мы получаем некоторое количество рибопереключателей. Надо выбрать из них тот, который функционирует лучше всего. Для этого «пришьем» каждый из них к специальному демонстрационному гену lacZ. Этот ген состоит из двух частей — участка транспозазы и последовательности, кодирующей бета-галактозидазу (подробнее о транспозазах см.: Растения заимствуют гены у «геномных паразитов», «Элементы», 26.11.2007). А дальше — просто: чем сильнее повышается уровень бета-галактозидазы в присутствии атразина, тем лучше работающий в клетке рибопереключатель.
Выбрав из всех рибопереключателей самый хороший, исследователи решили разобраться с тем, как он работает. В серии изящных экспериментов они смогли показать, что деятельность рибопереключателя связана с трансляцией, а не с транскрипцией. Кроме того, удалось создать модель работы рибопереключателя. Вначале, когда атразина рядом нет, его рибосомосвязывающий сайт блокируется атразинсвязывающим участком. Однако в присутствии атразина этот участок отодвигается, РНК «садится» на рибосому, и начинается синтез белка.
Разобравшись с тем, как работает рибопереключатель, ученые приступили ко второму этапу работы — им нужно было найти фермент, расщепляющий атразин. Тут проблем не было. Этот гербицид загрязняет окружающую среду вот уже шестьдесят лет, и многие микроорганизмы научились уничтожать его. Для данной работы исследователи использовали один из хорошо охарактеризованных генов — АtzA, который кодирует хлорогидролазу, превращающую атразин в гидроксиатразин. В отличие от атразина, гидроксиатразин — довольно мирное вещество. Это не гербицид, и предполагается, что он не наносит вреда человеческому здоровью. К тому же, он гораздо лучше атразина адсорбируется землей. Таким образом, превращение атразина в гидроксиатразин может оказаться полезным для восстановления зараженных почв.
Теперь осталось только создать те «волшебные» клетки кишечной палочки, которые бы могли находить и разлагать атразин. Ученые смоделировали их таким образом, что ген CheZ (который отвечает за движение и хемотаксис) находится под контролем рибопереключателя, а значит, работает только в присутствии атразина. В то же время ген АtzA (расщепляющий атразин) и ген зеленого флюоресцентного белка GFP (он делает клетки гораздо более заметными и к тому же позволяет отличить мутантные клетки от обычных) экспрессируются постоянно.
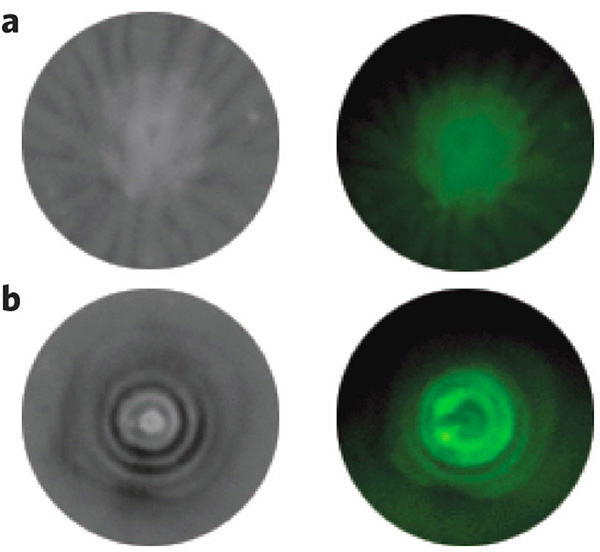
Чтобы проверить, как работают бактерии, исследователи рассеяли их на содержащую атразин агаровую среду. Среда была приготовлена таким образом, что при разложении атразина на ней образовывались хорошо заметные специфические пятна.
После инкубации в течение ночи на поверхности среды образовались круглые колонии, состоящие из чередующихся светлых и темных колец. Исследовав флюоресценцию GFP, ученые обнаружили, что светлые кольца образованы большим количеством клеток, в то время как на темных участках клеток гораздо меньше, а также, судя по пятнам на поверхности среды, меньше и атразина.
Предполагается, что кольца эти появляются так. Оказавшись в среде, богатой атразином, клетки расползаются в разные стороны со скоростью, пропорциональной его концентрации. Образуется круглая колония. Клеток в ней много — значит, они быстренько успевают разложить атразин, и им становится нечем заняться. Тогда самые «ушлые» из этих клеток успевают отползти дальше (в результате чего диаметр пятна увеличивается) и найти себе новые «атразиновые угодья». Оставшиеся клетки, оказавшись в безатразиновой среде, теряют всякое желание двигаться, поскольку при отсутствии атразина у них исчезает и псевдотаксис. Так в колонии возникают светлый и темный участок. Через некоторое время атразин кончается и во внешнем кольце; тогда клетки мигрируют дальше, в результате чего и появляются новые кольца.
Причем стоит отметить, что контрольные бактерии, лишенные гена АtzA (то есть способные ползти в сторону атразина, но не способные разлагать его), образуют просто круглые колонии без чередования светлых и темных участков и безо всяких пятен, свидетельствующих о катаболизме гербицида.
|
Всё это говорит о том, что эксперимент удался, и кишечные палочки способны находить и уничтожать атразин — а значит, открываются огромные возможности как для борьбы с загрязнением окружающей среды, так и для развития синтетической биологии в целом.
Конечно, многие вопросы еще не решены. Например, клетки кишечной палочки «не видят» атразин в низкой концентрации, и поэтому могут быть использованы только в крайне загрязненных местах. Но ведь эта работа — только начало, и в последующих экспериментах можно будет либо «докрутить» клетки E. Coli до более «атразиночуткого» состояния, либо использовать другой вид бактерий. Также, вполне возможно, окажется полезным «выключать» подвижность клеток не при отсутствии, а, наоборот, при наличии атразина — тогда они будут образовывать колонии в местах его скоплений, а справившись с ним — расползаться по своим делам.
Источник: Joy Sinha, Samuel J. Reyes, Justin P. Gallivan. Reprogramming bacteria to seek and destroy an herbicide. // Nature Chemical Biology (2010). V. 6. P. 464–470. Doi: 10.1038/nchembio.369.
Вера Башмакова