Нейрофибриллярные клубки при болезни Альцгеймера — не убийцы, а защитники клеток?
|
Как и большинство нейродегенеративных заболеваний, болезнь Альцгеймера характеризуется появлением внутриклеточных белковых включений в пораженных областях мозга. Раньше считалось, что именно эти включения и доводят клетку до гибели. Однако в недавней работе было показано, что, скорее всего, белковые агрегаты — это, наоборот, попытка клетки взять патологические процессы под контроль и избежать смерти.
Одна из общих черт почти всех нейродегенеративных заболеваний — возникновение в нейронах пораженных областей белковых агрегатов, образованных неверно сложенными белками. Такие белки могут принести клетке немало бед. Например, длинные нити белка хантингтина, состоящие из множества глютаминовых повторов, представляют собой что-то вроде рыбачьего невода, в котором может запутаться содержимое цитоплазмы. А неправильно сложенный прионный белок вызывает «перескладывание» аналогичного белка из клетки хозяина, что в конце концов приводит к ее смерти. Поэтому правильное сворачивание белков — необычайно важный процесс в жизни клетки.
|
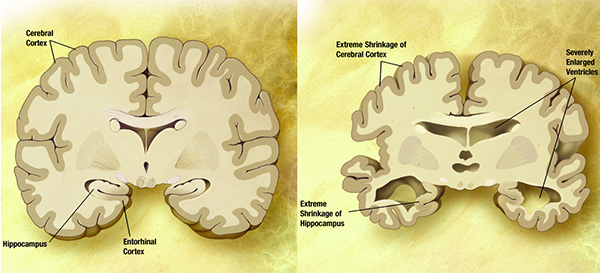
Болезнь Альцгеймера — это неизлечимая смертельная болезнь, проявляющаяся в прогрессирующем нарушении когнитивных функций (иными словами, утраты умения мыслить). У больных происходит постепенная потеря нейронов в коре больших полушарий, а также в некоторых подкорковых зонах. При изучении под микроскопом мозга, пораженного болезнью Альцгеймера, хорошо видны амилоидные бляшки на поверхности нейронов, образованные коротким пептидом бета-амилоидом, и внутриклеточные клубки белка тау. В норме тау-белок очень важен для клетки. Он может быть в фосфорилированном (активном) и дефосфорилированном (неактивном) состоянии. Будучи фосфорилированным, тау-белок стабилизирует микротрубочки и таким образом регулирует внутриклеточный транспорт. Однако гиперфосфорилирование тау имеет ужасные последствия — его молекулы становятся нерастворимыми и слипаются, образуя клубки, а у клетки возникают огромные проблемы из-за нарушения микротрубочкового транспорта.
Несколько лет назад было показано, что тау-белок расщепляется каспазами. Каспазы — это протеазы, выполняющие в клетке роль «палачей»: они запускают механизм запрограммированной клеточной смерти — апоптоз. Каспазы подразделяют на два типа — инициаторные и эффекторные. Инициаторные каспазы (8, 9 и 10) расщепляют эффекторные каспазы (3, 6 и 7) и таким образом активируют их. Активировавшись, эффекторные каспазы «идут вразнос» — запускают каскады реакций, вызывающие фрагментацию ДНК и деструкцию клетки. Тау-белок «режется» именно эффекторными каспазами, и получившийся «урезанный» тау агрегирует гораздо быстрее обычного. Логично предположить, что гибель клеток при болезни Альцгеймера как-то связана с взаимодействием между каспазами и тау-белком.
Чтобы проверить это предположение, группа исследователей из США и Франции провела серию экспериментов.
Опыты проводились на трансгенных мышах Tg4510, экспрессирующих мутантный человеческий тау-белок (он сильнее подвержен гиперфосфорилированию и поэтому лучше агрегирует, чем обычный тау). Эти мыши в семимесячном возрасте (который для мышей является довольно почтенным) показывают некоторые признаки болезни Альцгеймера: у них встречаются нейрофибриллярные клубки, а также происходит потеря значительного количества нейронов.
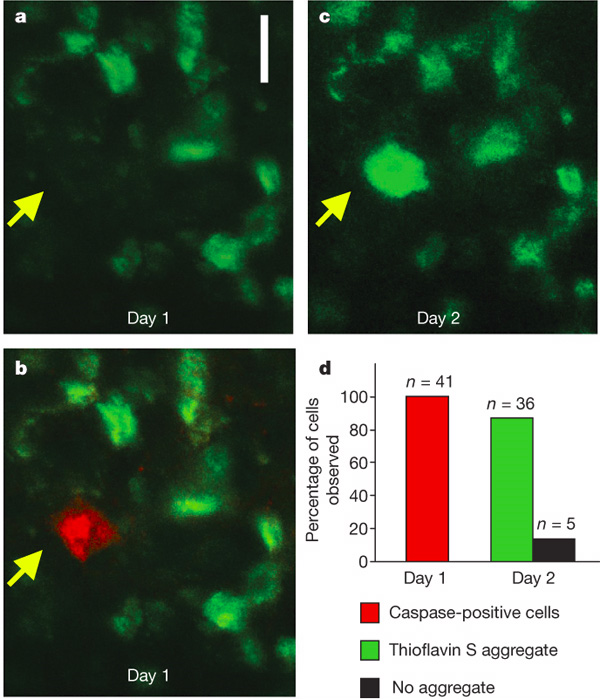
Чтобы узнать, как связана активность каспаз с образованием нейрофибриллярных клубков и с гибелью клеток, ученые использовали методику мультифотонной микроскопии (см. Multiphoton Excitation Microscopy). Этот метод позволяет наблюдать в микроскоп за живыми нейронами живых животных сквозь дырку в черепе. Чтобы «разглядеть» в клетках нейрофибриллярные клубки и каспазную активность, на поверхность мозга капают специальные красители.
В результате исследований оказалось, что большая часть (87%) «каспазных» нейронов содержит клубки. В то же время только в 10% нейронов, содержащих клубки, была зарегистрирована каспазная активность. Всё это подтверждало связь между активностью каспазы и агрегацией тау, но оставляло множество вопросов. Тогда ученые решили проследить судьбу «клубочковых» и «каспазных» нейронов в течение нескольких дней и узнать, какова динамика жизни клубочков и каспазной активности.
Удалось выяснить следующее. Если в нейроне появился клубок, он уже никуда не девается и не «рассасывается». Однако клетка при этом продолжает жить и, видимо, сносно себя чувствует. Интересно другое. Посмертные исследования «каспазно-клубочковых» нейронов показали, что в этих клетках ядро не повреждено, а значит, не доведена до конца программа клеточной смерти. То есть похоже на то, что, если в клетке есть нейрофибриллярный клубок, каспазы бессильны и уже не могут «убить» клетку.
|
Но самые сногсшибательные результаты были получены на «каспазно-бесклубочковых» нейронах. Эти клетки встречались необычайно редко: у семи животных при исследовании 56 участков мозга был обнаружен только 41 такой нейрон. Каково же было удивление исследователей, когда они обнаружили, что на следующий день в 36 из этих клеток появился нейрофибриллярный клубок! При этом возникновение клубка в «бескаспазном» нейроне — большая редкость, и наблюдается всего в 1,7% случаев (причем, скорее всего, в этих нейронах просто была пропущена кратковременная каспазная активность). Иными словами, активация каспаз вызывает формирование в клетках клубков менее чем за сутки. А поскольку в большинстве «клубочковых» нейронов каспазы были «выключены», то вполне возможно, что именно возникновение клубков помогает клетке выжить после каспазной «атаки».
Хорошо, но что же тогда запустило в клетках активность каспаз? Судя по всему, этим «переключателем» было присутствие в нейронах мутантного белка тау. При его отсутствии каспазы молчат — по крайней мере, ни у мышей дикого типа, ни у мышей, экспрессирующих APP (предшественник бета-амилоида, образующего амилоидные бляшки), никакой каспазной активности обнаружено не было. Если же «выключить» экспрессию мутантного тау (трансгенные мыши Tg4510 были выведены таким образом, чтобы эту экспрессию можно было «выключить» с помощью антибиотика доксициклина), то активность каспаз резко падает — после шести недель «выключения» тау почти в 20 раз!
И наоборот, если с помощью аденовируса вызвать экспрессию немутантного тау в мозге мышей дикого типа, то в некоторых нейронах появляется каспазная активность, а посмертные исследования показывают наличие в клетках «урезанного» каспазами тау. Также «урезанный» белок встречается и у мышей, оверэкспрессирующих человеческий немутантный тау. Все вместе эти данные позволяют предположить, что каспазы «включаются» при оверэкспрессии в нейронах тау-белка.
Остается еще один немаловажный вопрос: по какой причине тау-белок начинает агрегировать после того, как каспазы «выйдут на тропу войны»? In vitro было показано, что само наличие «урезанного» каспазами тау способно «включить» агрегацию. Чтобы проверить, работает ли этот принцип in vivo, ученые ввели вирус, кодирующий «урезанный» тау, мышам дикого типа. Выяснилось, что довольно солидный процент экспрессирующих «урезанный» тау нейронов показывает альцгеймероподобные изменения. Больше того, эндогенный («родной») клеточный тау меняет свое местоположение и локализуется вместе с «урезанным». Это серьезный аргумент в пользу того, что «урезанный» тау-белок может запустить процессы образования белковых агрегатов и «завербовать» для участия в них и нормальные молекулы тау.
Разумеется, множество вопросов остается без ответа. Каким образом нейронам удается избежать смерти после каспазной атаки? Что такое нейрофибриллярные клубки — защита для клетки, побочный результат каспазной активности или «медленное оружие», постепенно убивающее нейроны? Тем не менее полученные результаты значительно проясняют картину патогенеза при болезни Альцгеймера.
Источник: A. de Calignon, L. M. Fox, R. Pitstick, G. A. Carlson, B. J. Bacskai, T. L. Spires-Jones, B. T. Hyman. Caspase activation precedes and leads to tangles // Nature. V. 464. P. 1201–1204 (22 April 2010).
Вера Башмакова