Иммунная система принимает митохондрии за бактерии
|
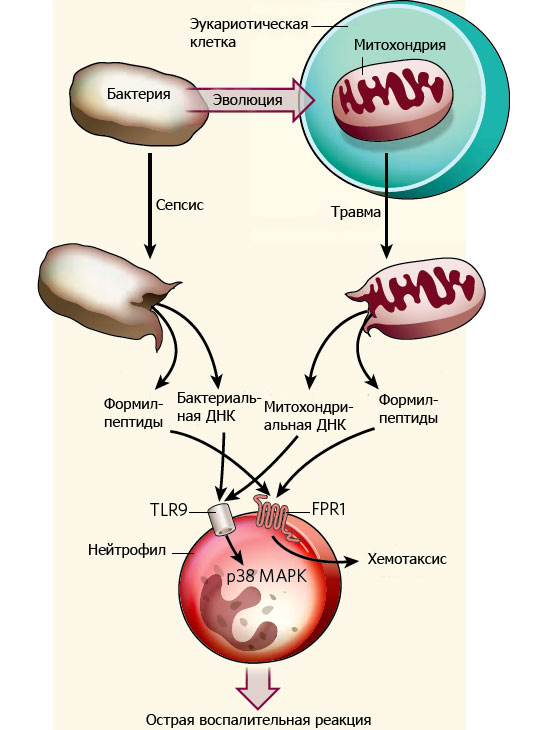
Даже при полном отсутствии бактериальной инфекции ранения и травмы могут приводить к воспалительной реакции, напоминающей сепсис. Как выяснилось, причины этого кроются в эволюционном прошлом митохондрий — клеточных органелл, ведущих свой род от симбиотических бактерий. При травме компоненты разрушенных митохондрий, сходные по своей структуре с компонентами бактериальных клеток (мтДНК и формил-пептиды), попадают в кровь, и иммунная система реагирует на них как на инфекцию.
Тяжелые травмы нередко приводят к так называемому «синдрому системного воспалительного ответа» (systemic inflammatory response syndrome, SIRS), который клинически очень похож на сепсис, но не обязательно связан с проникновением в кровь болезнетворных бактерий. Считалось, что причиной SIRS являются всё-таки бактерии, предположительно проникающие в кровь из кишечника при сильном стрессе. Но это предположение не подтвердилось, и причины SIRS в отсутствие инфекции долгое время оставались неясными.
Американским и британским ученым удалось разгадать эту загадку, о чём они сообщили в последнем номере журнала Nature. Авторы показали, что иммунный ответ вызывается компонентами разрушенных митохондрий, которые в больших количествах попадают в кровь при ранениях, ожогах и других травмах.
Известно, что митохондрии («энергетические станции» клетки, отвечающие за кислородное дыхание) являются потомками внутриклеточных симбиотических бактерий (см.: Происхождение эукариот). Митохондрии сохранили целый ряд типичных бактериальных признаков, в том числе на молекулярном уровне. В частности, трансляция (синтез белков) в митохондриях, как и у бактерий, всегда начинается с особой модифицированной аминокислоты — N-формилметионина. У архей и в цитоплазме эукариот эта аминокислота при синтезе белка не используется. Поэтому наличие N-формилметионина на конце белковой молекулы (или на концах более коротких молекул — формил-пептидов, образующихся при распаде бактериальных белков) является надежным индикатором присутствия бактерий.
Еще один важный «бактериальный» признак митохондрий — наличие в митохондриальной ДНК (мтДНК) неметилированных участков, содержащих расположенные вплотную друг к другу нуклеотиды Ц и Г (см. CpG_site). В ядерном геноме млекопитающих такие участки ДНК обычно подвергаются метилированию, но этого не происходит у бактерий и в митохондриях.
Эти молекулярные признаки используются иммунной системой для выявления бактериальных инфекций. За их распознавание отвечают полиморфонуклеарные нейтрофилы (Polymorphonuclear neutrophils, PMN) — одна из разновидностей белых кровяных клеток, входящих в состав системы врожденного иммунитета. На поверхности PMN имеются специальные рецепторы, распознающие бактериальную ДНК (они называются TLR9) и бактериальные формил-пептиды (за это отвечают рецепторы FPR1).
Авторы предположили, что воспалительный ответ при травме может быть связан с тем, что в кровь в большом количестве попадают белки и ДНК из разрушенных митохондрий, а клетки иммунной системы по ошибке принимают эти молекулы за бактериальные.
Сначала авторы проверили, действительно ли при травмах в кровь попадает много материала из разрушенных митохондрий. Для этого измерили уровень мтДНК в плазме крови у 15 пациентов с тяжелыми травмами, но без открытых ран и повреждений желудочно-кишечного тракта. Уровень мтДНК у них оказался в тысячи раз выше нормы и продолжал расти в течение суток после травмы. То же самое наблюдается и у больных, перенесших хирургические операции.
После этого авторы детально изучили реакцию PMN на фрагментированные митохондрии и отдельные их компоненты: митохондриальную ДНК и формил-пептиды. Оказалось, что эти молекулы вызывают у полиморфонуклеарных нейтрофилов такую же реакцию, как и аналогичные бактериальные вещества. В цитоплазме нейтрофилов резко возрастает концентрация кальция, они начинают выделять интерлейкин IL-8 (interleukin-8) и ползут туда, где выше концентрация веществ, высвободившихся из разрушенных митохондрий.
Специальные эксперименты показали, что митохондриальная ДНК распознается рецептором TLR9, а формил-пептиды — рецептором FPR1 (как и следовало ожидать, исходя из сходства этих митохондриальных веществ с бактериальными аналогами). Активированные нейтрофилы выделяют фермент MMP-8, который разрушает коллаген и позволяет нейтрофилам проникать вглубь тканей. При слишком большом количестве активированных нейтрофилов это может приводить к некрозу, то есть к гибели тканей. В случае настоящей бактериальной инфекции такие действия иммунной системы еще могут иметь смысл, потому что, копаясь в тканях, лейкоциты охотятся на микробов. Но если инфекции нет, от этой деятельности организму больше вреда, чем пользы. Кроме того, эксперименты показали, что нейтрофилы, «унюхавшие» разрушенные митохондрии, теряют способность реагировать на настоящие сигналы опасности — бактериальные формил-пептиды. В результате возрастает риск реальных посттравматических инфекций.
Эксперименты на крысах подтвердили, что компоненты разрушенных митохондрий могут приводить к тяжелым воспалительным реакциям. Внутривенное введение митохондриальных веществ вызвало у подопытных крыс воспаление легких и некроз тканей печени — всё это при полном отсутствии бактериальной инфекции. Эти жестокие эксперименты оправданы тем, что они помогут эффективнее бороться с тяжелыми воспалительными реакциями, возникающими после травм. Теперь стало окончательно ясно, что не всякий сепсис можно лечить антибиотиками: похожие симптомы могут развиться даже при полном отсутствии инфекции, и в этом случае они требуют совсем другого лечения.
Исследование показало, что система врожденного иммунитета млекопитающих действительно путает собственные митохондрии с болезнетворными бактериями. Эволюционное прошлое митохондрий, их бактериальное происхождение породило неожиданный побочный эффект, весьма неприятный для людей, получивших тяжелую травму. Это яркий пример несовершенства строения организмов, объясняющегося их эволюционной историей.
Почему же в ходе эволюции у нейтрофилов не выработались какие-то более точные способы узнавания бактерий, почему они не научились отличать их от своих собственных митохондрий? Возможно, дело в том, что формил-пептиды и детали строения бактериальной ДНК являются очень удобными и универсальными молекулярными маркерами, по которым можно быстро опознать любую бактерию. Отказ от этих маркеров в пользу каких-то менее универсальных признаков привел бы к снижению приспособленности, тем более что тяжелые травмы, о которых идет речь, всё равно оставляют диким животным мало шансов на выздоровление.
Источник: Qin Zhang, Mustafa Raoof, Yu Chen, Yuka Sumi, Tolga Sursal, Wolfgang Junger, Karim Brohi, Kiyoshi Itagaki, Carl J. Hauser. Circulating mitochondrial DAMPs cause inflammatory responses to injury // Nature. 2010. V. 464. P. 104–107.
Александр Марков