Сложность организма связана обратной зависимостью с содержанием тирозина в белках
|
Усложнение организмов в ходе эволюции сопровождалось ростом разнообразия тирозин-киназ — регуляторных белков, которые фосфорилируют остатки тирозина в других белках и таким образом управляют их работой. Канадские биологи обнаружили, что чем сложнее устроен организм, тем реже встречается тирозин в его белках. Очевидно, по мере развития тирозин-киназной регуляции естественный отбор способствовал удалению многих тирозинов, что помогало избавиться от «случайного шума» в межбелковых взаимодействиях.
Эволюция по пути к усложнению (иногда ее называют «прогрессивной эволюцией») не является всеобщей и абсолютной закономерностью, однако у многоклеточных животных (Metazoa) эта тенденция прослеживается довольно отчетливо. До сих пор, однако, мы довольно мало знаем о генетических основах усложнения организмов в ходе эволюции. Один из самых удивительных фактов состоит в том, что сложность организма довольно слабо коррелирует с размером генома или с общим числом генов в нем (сложность организма легче всего оценить по числу типов клеток, входящих в его состав). По всей видимости, усложнение строения животных происходило не столько за счет появления новых генов, сколько за счет развития новых связей (регуляторных взаимодействий) между уже существующими генами.
Новые гены, безусловно, тоже появлялись, но не очень часто, и это были в основном регуляторные гены, координирующие работу сложного «генного хозяйства» многоклеточного организма. Число и разнообразие некоторых разновидностей регуляторных белков (и, соответственно, кодирующих их генов) закономерно возрастало по мере усложнения организма. К числу таких белков относятся тирозин-киназы — специализированные регуляторные белки, функция которых состоит в фосфорилировании остатков тирозина, входящих в состав других белков. Фосфорилирование тирозинов может влиять на свойства белка как напрямую (например, увеличивая его активность), так и косвенно — через посредничество других регуляторных белков, которые распознают фосфорилированные остатки тирозина и прикрепляются к ним, что, в свою очередь, влияет на свойства модифицированного белка.
Ранее было замечено, что чем сложнее организм, тем больше у него разных тирозин-киназ. Новые тирозин-киназы в ходе эволюции животных появлялись стандартным путем — через удвоение генов и последующее разделение функций между ними. По-видимому, разные тирозин-киназы обладают разной специфичностью. Иными словами, они фосфорилируют остатки тирозинов, находящиеся в разных аминокислотных «контекстах». Однако избирательность действия тирозин-киназ трудно довести до совершенства, поскольку тирозин входит в состав огромного множества белков. В таких условиях довольно трудно добиться, чтобы каждая тирозин-киназа совершала только полезную работу и никогда не фосфорилировала ничего «лишнего». По-видимому, появление каждой новой тирозин-киназы должно было сопровождаться более или менее сильными «побочными эффектами», состоявшими в том, что фосфорилированию начинали подвергаться некоторые белки, которые, с точки зрения пользы для организма, фосфорилировать вовсе не обязательно или даже вредно.
Снизить уровень «шума» в межбелковых взаимодействиях можно двумя путями. Во-первых, можно улучшить распознающие способности белка-регулятора. Любые мутации, ведущие к более точному выбору «мишени» регуляторным белком, будут поддерживаться отбором.
Второй возможный путь состоит в устранении лишних мишеней, то есть тирозинов, фосфорилирование которых вредно для организма, но которые тем не менее фосфорилируются имеющимися тирозин-киназами. В данном случае направленность отбора будет зависеть от того, что вреднее: «ошибочное» фосфорилирование или замена тирозина какой-нибудь другой аминокислотой. Если первый вариант более вреден, отбор поддержит мутацию, ведущую к замене аминокислоты.
Выбор одного из двух путей оптимизации регуляторной сети каждый раз будет во многом зависеть от случайности: какая мутация раньше произойдет.
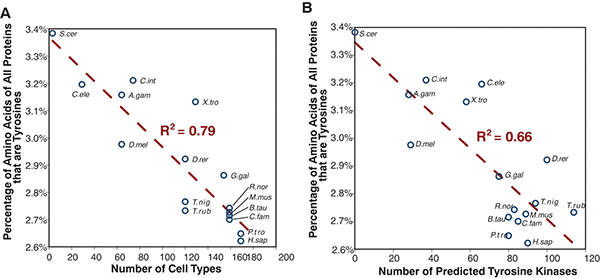
Канадские ученые проанализировали прочтенные геномы животных, чтобы проверить, действительно ли по мере роста разнообразия тирозин-киназ в ходе эволюции животных некоторые тирозины в белках удалялись или заменялись другими аминокислотами. Полученные результаты убедительно подтвердили это предположение.
Оказалось, что чем сложнее организм, тем ниже содержание тирозина в его белках. У представителя одноклеточных (пекарские дрожжи) на каждую тысячу закодированных в геноме аминокислот приходится 34 тирозина; у просто устроенных животных, таких как червь Caenorhabditis elegans или асцидия Ciona intestinalis — 31-32, у млекопитающих, включая человека, — 26-27. Кроме того, обнаружилась сильная отрицательная корреляция между содержанием тирозина в белках и количеством закодированных в геноме тирозин-киназ (эта закономерность тесно связана с предыдущей, поскольку, как мы уже знаем, сложность организма положительно коррелирует с числом тирозин-киназ). Содержание тирозина в белках также связано отрицательной зависимостью с числом фосфотирозин-связывающих белков (эти регуляторные белки распознают фосфорилированные тирозины и взаимодействуют с ними).
Авторы предположили, что аналогичная закономерность должна наблюдаться и в отношении других аминокислот, которые подвергаются модификациям в ходе регуляторных межбелковых взаимодействий. Кроме тирозина, фосфорилированию могут подвергаться также аминокислоты треонин и серин (за это отвечают ферменты серин/треонин-киназы). Оказалось, что частота встречаемости треонина находится в сильной обратной зависимости от сложности организма и от числа закодированных в геноме серин/треонин киназ, однако частота встречаемости серина не зависит от этих показателей. Причины этого пока не ясны; авторы предполагают, что дело тут в каких-то функциональных различиях между фосфорилированием треонина и серина у животных.
|
Кроме того, авторы выявили отрицательную зависимость между сложностью организма и частотой встречаемости аминокислот, которые могут подвергаться другим модификациям (метилированию и гликозилированию) в ходе межбелковых взаимодействий.
Данная работа интересна тем, что она проливает немного света на пока еще совсем темную область эволюционной биологии — генетические основы эволюции сложных систем, в том числе сложных регуляторных сетей. Полученные результаты показывают, что усложнение системы происходит путем встраивания в нее новых компонентов, причем на первых порах это может приводить к множеству нежелательных побочных эффектов, которые постепенно сглаживаются в ходе последующей оптимизации и взаимной подгонки регуляторов и их мишеней. Работа также хорошо иллюстрирует «компромиссный» характер эволюции новых полезных свойств, что ведет к несовершенству адаптаций. Отбору часто приходится выбирать не наилучший из принципиально возможных вариантов, а наименьшее из зол.
Источник: Chris Soon Heng Tan, Adrian Pasculescu, Wendell A. Lim, Tony Pawson, Gary D. Bader, Rune Linding. Positive Selection of Tyrosine Loss in Metazoan Evolution // Science. 2009. V. 325. P. 1686–1688.
Александр Марков