Расшифрован молекулярный механизм превращения трехкамерного сердца в четырехкамерное
|
Появление четырехкамерного сердца у птиц и млекопитающих было важнейшим эволюционным событием, благодаря которому эти животные смогли стать теплокровными. Детальное изучение развития сердца у эмбрионов ящерицы и черепахи и сравнение его с имеющимися данными по амфибиям, птицам и млекопитающим показало, что ключевую роль в превращении трехкамерного сердца в четырехкамерное сыграли изменения в работе регуляторного гена Tbx5, который функционирует в изначально едином зачатке желудочка. Если Tbx5 эспрессируется (работает) равномерно по всему зачатку, сердце получается трехкамерным, если только с левой стороны — четырехкамерным.
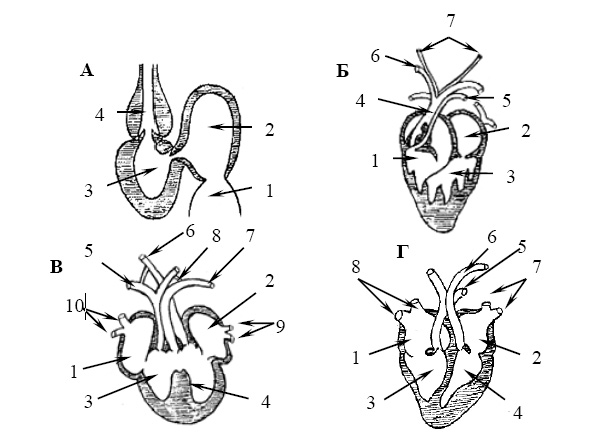
Выход позвоночных на сушу был связан с развитием легочного дыхания, что потребовало радикальной перестройки кровеносной системы. У дышащих жабрами рыб один круг кровообращения, а сердце, соответственно, двухкамерное (состоит из одного предсердия и одного желудочка). У наземных позвоночных — трех- или четырехкамерное сердце и два круга кровообращения. Один из них (малый) прогоняет кровь через легкие, где она насыщается кислородом; затем кровь возвращается к сердцу и попадает в левое предсердие. Большой круг направляет обогащенную кислородом (артериальную) кровь ко всем прочим органам, где она отдает кислород и по венам возвращается к сердцу, попадая в правое предсердие.
У животных с трехкамерным сердцем кровь из обоих предсердий попадает в единый желудочек, откуда она затем направляется и к легким, и ко всем прочим органам. При этом артериальная кровь в той или иной степени смешивается с венозной. У животных с четырехкамерным сердцем в ходе эмбрионального развития изначально единый желудочек подразделяется перегородкой на левую и правую половины. В результате два круга кровообращения оказываются полностью разделены: венозная кровь попадает только в правый желудочек и идет оттуда к легким, артериальная — только в левый желудочек и идет оттуда ко всем прочим органам.
|
Формирование четырехкамерного сердца и полное разделение кругов кровообращения было необходимой предпосылкой развития теплокровности у млекопитающих и птиц. Ткани теплокровных животных потребляют очень много кислорода, поэтому им необходима «чистая» артериальная кровь, максимально насыщенная кислородом, а не смешанная артериально-венозная, которой довольствуются холоднокровные позвоночные с трехкамерным сердцем (см.: Филогенез кровеносной системы хордовых).
Трехкамерное сердце характерно для амфибий и большинства рептилий, хотя у последних намечается частичное разделение желудочка на две части (развивается неполная внутрижелудочковая перегородка). Настоящее четырехкамерное сердце развилось независимо в трех эволюционных линиях: у крокодилов, птиц и млекопитающих. Это считается одним из ярких примеров конвергентной (или параллельной) эволюции (см.: Ароморфозы и параллельная эволюция; Параллелизмы и гомологическая изменчивость).
Большая группа исследователей из США, Канады и Японии, опубликовавшая свои результаты в последнем номере журнала Nature, задалась целью выяснить молекулярно-генетические основы этого важнейшего ароморфоза.
Авторы детально изучили развитие сердца у эмбрионов двух рептилий — красноухой черепахи Trachemys scripta и ящерицы анолиса (Anolis carolinensis). Рептилии (кроме крокодилов) представляют особый интерес для решения поставленной задачи, поскольку строение их сердца по многим признакам — промежуточное между типичным трехкамерным (таким, как у амфибий) и настоящим четырехкамерным, как у крокодилов, птиц и зверей. Между тем, по утверждению авторов статьи, вот уже 100 лет никто всерьез не изучал эмбриональное развитие сердца рептилий.
Исследования, выполненные на других позвоночных, до сих пор не дали однозначного ответа на вопрос о том, какие генетические изменения обусловили формирование четырехкамерного сердца в ходе эволюции. Было, однако, замечено, что регуляторный ген Tbx5, кодирующий белок — регулятор транскрипции (см. транскрипционные факторы), по-разному работает (экспрессируется) в развивающемся сердце у амфибий и теплокровных. У первых он равномерно экспрессируется по всему будущему желудочку, у вторых его экспрессия максимальна в левой части зачатка, из которой в дальнейшем формируется левый желудочек, и минимальна справа. Обнаружилось также, что уменьшение активности Tbx5 ведет к дефектам в развитии перегородки между желудочками. Эти факты позволили авторам предположить, что изменения в активности гена Tbx5 могли сыграть какую-то роль в эволюции четырехкамерного сердца.
В ходе развития сердца ящерицы в желудочке развивается мышечный валик, частично отделяющий выходное отверстие желудочка от его основной полости. Этот валик некоторыми авторами трактовался как структура, гомологичная межжелудочной перегородке позвоночных с четырехкамерным сердцем. Авторы обсуждаемой статьи на основе изучения роста валика и его тонкой структуры отвергают эту трактовку. Они обращают внимание на то, что такой же валик ненадолго появляется и в ходе развития сердца куриного эмбриона — наряду с настоящей перегородкой.
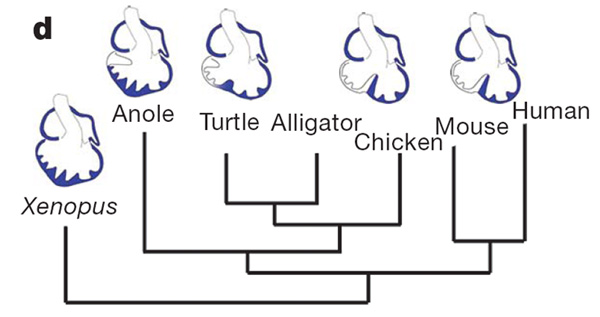
Полученные авторами данные свидетельствуют о том, что у ящерицы никаких структур, гомологичных настоящей межжелудочной перегородке, по-видимому, не формируется. У черепахи, напротив, формируется неполная перегородка (наряду с менее развитым мышечным валиком). Формирование этой перегородки у черепахи начинается намного позже, чем у цыпленка. Тем не менее получается, что у ящерицы сердце более «примитивное», чем у черепахи. Сердце черепахи занимает промежуточное положение между типичным трехкамерным (таким как у амфибий и ящериц) и четырехкамерным, таким как у крокодилов и теплокровных. Это противоречит общепринятым представлениям об эволюции и классификации рептилий. На основе анатомических признаков черепах традиционно считали самой примитивной (базальной) группой среди современных рептилий. Однако сравнительный анализ ДНК, проведенный рядом исследователей, раз за разом упрямо указывал на близость черепах к архозаврам (группе, включающей крокодилов, динозавров и птиц) и на более базальное положение чешуйчатых (ящериц и змей). Строение сердца подтверждает эту новую эволюционную схему (см. рисунок).
|
Авторы изучили экспрессию нескольких регуляторных генов в развивающемся сердце черепахи и ящерицы, в том числе гена Tbx5. У птиц и млекопитающих уже на очень ранних стадиях эмбриогенеза в зачатке желудочков образуется резкий градиент экспрессии этого гена (экспрессия быстро убывает слева направо). Оказалось, что у ящерицы и черепахи на ранних стадиях ген Tbx5 экспрессируется так же, как у лягушки, то есть равномерно по всему будущему желудочку. У ящерицы такая ситуация сохраняется до конца эмбриогенеза, а у черепахи на поздних стадиях формируется градиент экспрессии — по существу, такой же, как у цыпленка, только выраженный слабее. Иными словами, в правой части желудочка активность гена постепенно снижается, а в левой остается высокой. Таким образом, по характеру экспрессии гена Tbx5 черепаха тоже занимает промежуточное положение между ящерицей и курицей.
Известно, что белок, кодируемый геном Tbx5, является регуляторным — он регулирует активность многих других генов. На основе полученных данных естественно было предположить, что развитие желудочков и закладка межжелудочковой перегородки идут под управлением гена Tbx5. Ранее уже было показано, что уменьшение активности Tbx5 у мышиных эмбрионов ведет к дефектам в развитии желудочков. Этого, однако, было недостаточно, чтобы считать доказанной «руководящую» роль Tbx5 в формировании четырехкамерного сердца.
Для получения более веских доказательств авторы использовали несколько линий генетически модифицированных мышей, у которых в ходе эмбрионального развития ген Tbx5 можно было отключать в той или иной части сердечного зачатка по желанию экспериментатора.
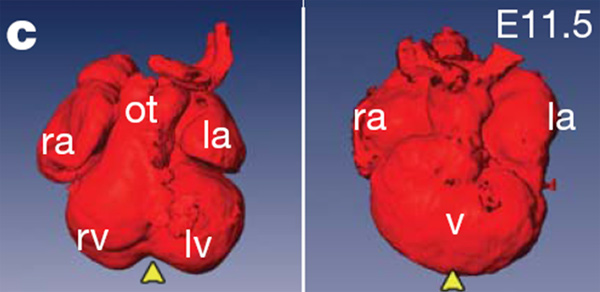
Оказалось, что если выключить ген во всем зачатке желудочков, то зачаток даже не начинает подразделяться на две половинки: из него развивается единый желудочек без всяких следов межжелудочной перегородки. Характерные морфологические признаки, по которым можно отличить правый желудочек от левого независимо от наличия перегородки, тоже не формируются. Иными словами, получаются мышиные зародыши с трехкамерным сердцем! Такие зародыши погибают на 12-й день эмбрионального развития.
Следующий эксперимент состоял в том, что ген Tbx5 отключили только в правой части зачатка желудочков. Тем самым градиент концентрации регуляторного белка, кодируемого этим геном, был резко смещен влево. В принципе, можно было ожидать, что в такой ситуации межжелудочная перегородка начнет формироваться левее, чем положено. Но этого не произошло: перегородка не начала формироваться вовсе, зато наметилось подразделение зачатка на левую и правую части по другим морфологическим признакам. Это значит, что градиент экспрессии Tbx5 — не единственный фактор, управляющий развитием четырехкамерного сердца.
В другом эксперименте авторам удалось добиться, чтобы ген Tbx5 равномерно экспрессировался во всем зачатке желудочков мышиного эмбриона — примерно так же, как у лягушки или ящерицы. Это опять-таки привело к развитию мышиных эмбрионов с трехкамерным сердцем.
Полученные результаты показывают, что изменения в работе регуляторного гена Tbx5 действительно могли сыграть важную роль в эволюции четырехкамерного сердца, причем эти изменения произошли параллельно и независимо у млекопитающих и архозавров (крокодилов и птиц). Таким образом, исследование еще раз подтвердило, что в эволюции животных ключевую роль играют изменения в активности генов — регуляторов индивидуального развития.
Конечно, было бы еще интереснее сконструировать таких генно-модифицированных ящериц или черепах, у которых Tbx5 экспрессировался бы как у мышей и кур, то есть в левой части желудочка сильно, а в правой — слабо, и посмотреть, не станет ли у них от этого сердце больше похожим на четырехкамерное. Но это пока технически неосуществимо: генная инженерия рептилий еще не продвинулась так далеко.
Источник: Koshiba-Takeuchi et al. Reptilian heart development and the molecular basis of cardiac chamber evolution // Nature. 2009. V. 461. P. 95–98.
Александр Марков