Химики преодолели главное препятствие на пути к абиогенному синтезу РНК
|
Попытки воспроизвести в лаборатории ключевой этап добиологической эволюции — синтез активированных рибонуклеотидов из простейших органических соединений — до сих пор не приводили к успеху из-за упорного нежелания рибозы и азотистого основания соединяться друг с другом. Британские химики нашли изящный обходной путь, позволяющий получить нуклеотиды Ц и У в условиях, которые вполне могли существовать в мелких водоемах на ранней Земле.
В заметке Тайна происхождения жизни скоро будет разгадана? («Элементы», 12.01.2009) мы рассказали об одной из проблем, стоящих перед учеными, которые пытаются разгадать эту тайну. Проблема состоит в том, что химикам до сих пор не удалось подобрать реалистичные условия, в которых из азотистых оснований, рибозы и фосфорной кислоты сами собой синтезировались бы рибонуклеотиды — «строительные блоки», из которых затем может образоваться молекула РНК. И азотистые основания, и рибоза могут формироваться самопроизвольно из простейших ингредиентов в условиях, которые могли существовать на древней Земле и даже в космосе, в протопланетном облаке. Но вот объединяться вместе, чтобы образовать рибонуклеотид, они в этих условиях наотрез отказываются. Точнее говоря, пуриновые нуклеотиды (аденозин А, гуанозин Г) синтезируются, но с низкой эффективностью, а пиримидиновые (уридин У, цитидин Ц) не синтезируются совсем. Кроме того, очень трудно получить рибозу и «правильные» азотистые основания в достаточно чистом виде. Обычно образуется чудовищная смесь всевозможных сахаров или азотистых соединений, в которой «нужные» вещества составляют лишь незначительный процент. В ходе дальнейших самопроизвольных реакций все эти вещества соединяются друг с другом тысячами разных способов, и обычно всё кончается образованием нерастворимых смол, из которых уже почти невозможно получить что-то путное.
В той же заметке говорилось о том, что химик Джон Сазерленд (John Sutherland) и его коллеги из Манчестерского университета (Великобритания) нашли «обходной путь», позволяющий синтезировать рибонуклеотиды не из готовых крупных блоков — рибозы и азотистых оснований — а из более простых органических молекул. Мы тогда сообщили, что Сазерленд и его коллеги готовят к публикации статью, в которой будут разрешены основные проблемы синтеза РНК из простейшей органики. В последнем номере журнала Nature эта статья наконец вышла, и теперь мы можем узнать, что же придумали британские химики.
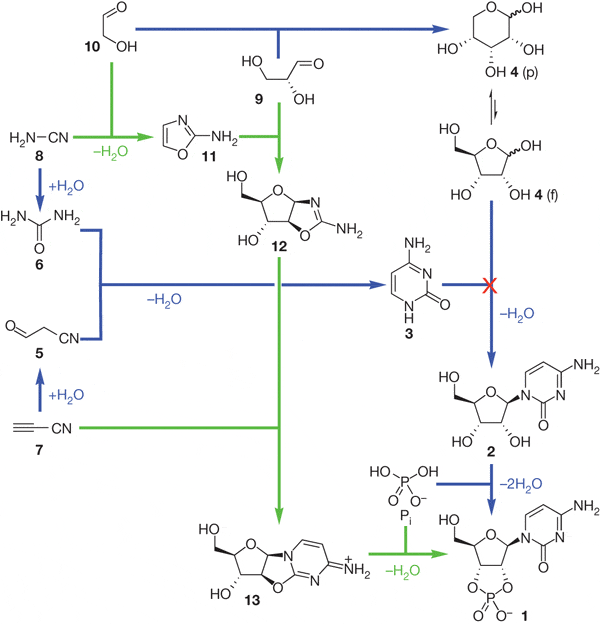
В основе их открытия лежат три замечательные находки. Первая состоит в том, что они догадались сразу добавить в реакционную смесь фосфорную кислоту (неорганический фосфат). До сих пор все исходили из естественного допущения, что фосфат нужен только на последней стадии синтеза рибонуклеотида, когда фосфат присоединяется к рибозе, которая до этого уже присоединилась к азотистому основанию. Однако оказалось, что фосфат необходим и на ранних стадиях процесса. Его присутствие резко снижает выход разнообразных «ненужных» веществ в ходе реакций и повышает выход «нужных». Вторая находка состоит в том, что исследователи с самого начала поместили в реакционную смесь и вещества, основанные на углероде и кислороде (простейшие углеводы), и азотистые соединения. До сих пор с этими двумя классами веществ работали по отдельности, пытаясь из первых синтезировать сахара, а из вторых — азотистые основания. Смешивать их в одну кучу с самого начала считалось бесперспективным, так как это резко повышает химическую «комбинаторику», то есть разнообразие получаемых продуктов, и без того слишком большое. Но фосфат резко снижает эту комбинаторику, и в результате из исходной смеси эффективно синтезируются в большом количестве ключевые промежуточные продукты, не являющиеся ни сахарами, ни азотистыми основаниями (на рисунке они обозначены числами 11 и 12).
Все вещества исходной смеси вполне могли существовать на ранней Земле. Кроме фосфата, в смесь входят простейшие азотистые соединения — цианоацетилен (7) и цианамид (8) и простейшие углеводы — гликольальдегид (10) и глицеральдегид (9). В присутствии фосфата вещества 8 и 10 с большой эффективностью соединяются и образуют вещество 11 (2-амино-оксазол). Следующая реакция (соединение веществ 11 и 9) обычно ведет к образованию множества побочных продуктов, однако присутствие фосфата снова оказывается спасительным, резко повышая выход «нужного» вещества 12 (арабинозо-амино-оксазолин).
На следующем этапе вещество 12 реагирует с цианоацетиленом (7). В обычном водном растворе эта реакция сопровождается временным повышением pH, в результате чего промежуточные продукты гидролизуются, цианоацетилен начинает реагировать с гидроксильными группами, и в итоге получается смесь «ненужных» продуктов, от которых нельзя проложить путь к рибонуклеотидам. Однако и в этом случае на помощь приходит фосфат: он играет роль буфера, в его присутствии pH не повышается, и «вредный» гидролиз резко замедляется. Более того, избыток цианоацетилена начинает реагировать не с гидроксильными группами «полезных» промежуточных продуктов, а с фосфатом, и в результате выход нужного вещества 13 (арабинозо-ангидронуклеозид) из практически никакого становится очень высоким. Таким образом, в данном случае фосфат выполняет сразу две полезные функции, выступая в роли стабилизатора кислотности и «химического буфера».
Теперь до настоящего активированного рибонуклеотида, пригодного для синтеза РНК, остался один шаг (об активированных нуклеотидах см. Искусственные протоклетки синтезируют ДНК без помощи ферментов, «Элементы», 09.06.2008). Вещество 13 нужно фосфорилировать, чтобы оно превратилось в активированный рибонуклеотид Ц (бета-рибоцитидин-2’,3’-циклофосфат; на рисунке это вещество обозначено номером 1).
Как выяснилось, для этого реакционную смесь нужно только немного подогреть («настало утро, вода в луже согрелась»), а всё необходимое в ней уже имеется. Роль ключевого катализатора реакции фосфорилирования берет на себя, как ни странно, мочевина (6), которая образуется сама собой из излишков цианамида, изначально присутствовавшего в смеси. Наличие мочевины открывает для фосфорилирования сразу два возможных пути. В первом случае может использоваться непосредственно фосфат (для этого в смеси должно присутствовать еще одно простое вещество — формамид). Во втором случае в ход идет пирофосфат, который образуется сам собой из тех веществ, что образовались ранее в ходе реакции фосфата с цианоацетиленом. И в этом случае формамид уже не нужен.
Открытый авторами путь абиогенного синтеза цитидина поражает своим изяществом. Особенно впечатляет неоднократное использование побочных продуктов, получающихся на предыдущих этапах пути, в качестве необходимых помощников на следующих этапах.
Но это еще не всё. Вместе с «правильным» нуклеотидом Ц в ходе последней реакции получается и ряд других, «неправильных» нуклеозидов и нуклеотидов, которые мешают дальнейшему синтезу «правильных» молекул РНК. Авторы стали искать способ избавиться от этих побочных продуктов. Кроме того, они надеялись получить из цитидина еще и второй пиримидиновый нуклеотид — уридин (У).
То, что они в итоге обнаружили, слегка похоже на чудо. Оказалось, что обе цели достигаются одной простой мерой — ультрафиолетовым облучением, которого, конечно, на древней Земле было вдоволь, поскольку озоновый слой отсутствовал. Под воздействием ультрафиолета все «лишние» нуклеотиды постепенно разрушаются, а цитидин остается, и часть его превращается в уридин. В отличие от всех остальных пиримидиновых нуклеотидов, Ц и У оказались устойчивы к ультрафиолету. Не правда ли, это очень похоже на четкий и простой ответ на вопрос о том, почему из всех возможных пиримидиновых нуклеотидов в состав РНК вошли именно Ц и У?
Есть ряд дополнительных химических нюансов, делающих открытие британских химиков еще более замечательным. Например, ключевое промежуточное соединение 2-амино-оксазол (11) способно к «самоочищению» и накоплению в высоких концентрациях благодаря своей повышенной летучести. Днем, под жаркими лучами солнца, оно могло испаряться из водоемов, а ночью или где-нибудь в горах — конденсироваться, выпадая в виде «органического снега». Так могли создаваться большие запасы этого вещества, готовые к дальнейшим этапам превращения в РНК.
Авторы нашли принципиально новый подход к абиогенному синтезу нуклеотидов, решили одну из труднейших проблем в теории происхождения жизни и открыли широкий простор для дальнейших исследований. Мне кажется, что дело тут пахнет Нобелевкой. Следующим шагом, естественно, должен стать поиск путей синтеза пуриновых нуклеотидов — А и Г. В популярном синопсисе, который сопровождает статью в журнале Nature, чувствуется нескрываемый восторг. В частности, там сказано: «Именно потому, что эта работа открывает так много новых направлений исследований, она на многие годы останется одним из великих достижений пребиотической химии» (But it is precisely because this work opens up so many new directions for research that it will stand for years as one of the great advances in prebiotic chemistry).
Источники:
1) Matthew W. Powner, Beatrice Gerland, John D. Sutherland. Synthesis of activated pyrimidine ribonucleotides in prebiotically plausible conditions // Nature. 2009. V. 459. P. 239–242.
2) Jack W. Szostak. Origins of life: Systems chemistry on early Earth // Nature. 2009. V. 459. P. 171–172.