Генетический код допускает разночтения
|
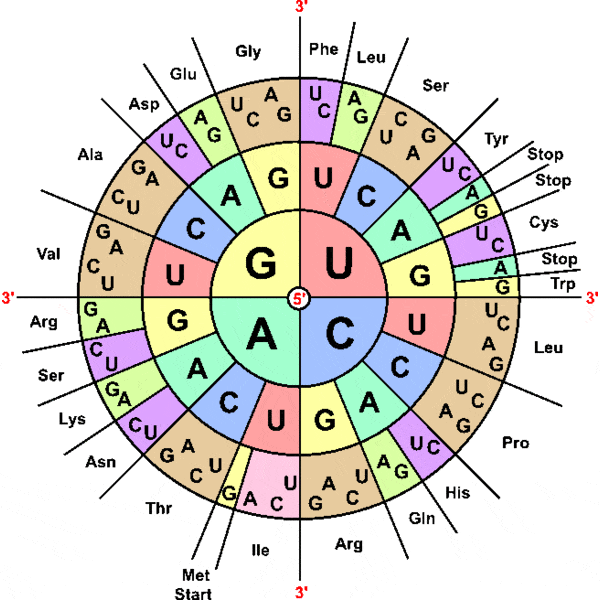
Генетический код основан на однозначном соответствии каждого кодона (тройки нуклеотидов) определенной аминокислоте. Это правило, казавшееся нерушимым, не выполняется у инфузории Euplotes, у которой в пределах одного и того же гена кодон UGA может кодировать две разных аминокислоты — цистеин или селеноцистеин. Подлинный смысл каждого конкретного кодона UGA определяется специальной регуляторной последовательностью нуклеотидов в некодирующей части гена.
Селеноцистеин (selenocysteine) — нестандартная «двадцать первая» аминокислота, отличающаяся от обычного цистеина тем, что вместо атома серы в ее состав входит атом селена. Селеноцистеин является обязательным компонентом нескольких важных ферментов в организме животных (включая человека), простейших, бактерий и архей. Белки, содержащие селеноцистеин, называют селенопротеинами (selenoproteins). В геноме человека содержится более 20 генов селенопротеинов, поэтому селен является необходимым компонентом питания, и его недостаток в пище приводит к различным заболеваниям.
Стандартный генетический код, однако, предусматривает возможность кодирования только двадцати «канонических» аминокислот, и для того, чтобы закодировать двадцать первую, эволюции пришлось пойти на хитрость. Для кодирования селеноцистеина используется кодон UGA, который по умолчанию является стоп-кодоном, то есть сигнализирует об окончании синтеза белковой молекулы. Однако если за кодирующим участком гена следует особая последовательность нуклеотидов, которая называется SECIS (selenocysteine insertion sequence), аппарат синтеза белка интерпретирует кодон UGA как кодирующий селеноцистеин.
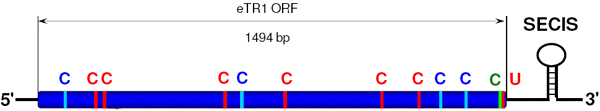
У организмов, в геноме которых есть гены селенопротеинов, имеется специальная селенопротеиновая транспортная РНК, которая распознает кодон UGA при помощи комплементарного ему антикодона UCA. Последовательность SECIS в ходе транскрипции включается в состав матричной РНК, синтезируемой на основе селенопротеинового гена. Оказавшись в составе матричной РНК, SECIS сворачивается в особую трехмерную структуру — «шпильку» с двумя петельками (см. рисунок), которая и служит сигналом, заставляющим аппарат синтеза белка присоединить к кодону UGA транспортную РНК, несущую селеноцистеин.
Антон Туранов и Вадим Гладышев из Университета штата Небраска (Линкольн, США) и их коллеги из нескольких американских научных институтов изучили механизм кодирования селеноцистеина у инфузории Euplotes. Эта инфузория интересна тем, что у нее, в отличие от других инфузорий и подавляющего большинства живых существ, кодон UGA не является стоп-кодоном и «по умолчанию» кодирует цистеин. Исследователи подумали, что если у Euplotes есть селенопротеины, то эта инфузория может оказаться единственным организмом, у которого один и тот же триплет нуклеотидов кодирует, в зависимости от контекста, две разные аминокислоты.
|
В ядерном геноме Euplotes найдено целых три гена транспортных РНК, распознающих кодон UGA: селеноцистеиновая тРНК и два варианта цистеиновой тРНК. В митохондриальном геноме Euplotes кодон UGA кодирует триптофан, и в соответствии с этим имеется еще четвертая, митохондриальная триптофановая тРНК, распознающая этот кодон.
Чтобы проверить, насколько универсальным является механизм кодирования селеноцистеина у разных организмов, исследователи пересадили селенопротеиновые гены инфузории (вместе с последовательностями SECIS) в человеческие эмбриональные клетки. Оказалось, что человеческий аппарат синтеза белка правильно понимает смысл тех кодонов UGA в генах инфузории, которые кодируют селеноцистеин. Человеческие клетки успешно синтезировали селенопротеины на основе генов инфузории, используя при этом человеческую селеноцистеиновую тРНК. Однако это произошло только с теми селенопротеиновыми генами инфузории, в которых кодон UGA один, и он кодирует селеноцистеин. Наткнувшись на кодон UGA, кодирующий у инфузории цистеин, человеческие клетки интерпретировали его как стоп-кодон и прекращали синтез белковой молекулы. Что и понятно, ведь у человека нет цистеиновых тРНК, распознающих кодон UGA.
Исследователи также попытались выяснить, каким образом клетка понимает, какие из кодонов UGA в пределах данного гена следует интерпретировать как цистеиновые, а какие — как селеноцистеиновые. Как выяснилось, это зависит от структуры SECIS. Каждый вариант последовательности SECIS указывает клетке на строго определенный участок гена длиной в несколько десятков нуклеотидов, в пределах которого все кодоны UGA интерпретируются как селеноцистеиновые. За пределами этого участка кодоны UGA трактуются в соответствии с их значением «по умолчанию»: у инфузорий — как цистеиновые, у человека — как стоп-кодоны.
От структуры последовательности SECIS зависит, на каком расстоянии от конца гена будет располагаться участок, в пределах которого все UGA будут транслироваться в селеноцистеин. Значение тонких различий в структуре SECIS понимается одинаково инфузориями и человеческими клетками. Чтобы выяснить всё это, исследователи конструировали и вставляли в человеческие клетки различные модифицированные варианты селенопротеиновых генов (передвигали с места на место кодоны UGA, заменяли один вариант SECIS на другой и т. д.).
Таким образом, генетический код, «в норме» используемый для кодирования 20 аминокислот, при необходимости может быть расширен. Кроме селеноцистеина, который считают 21-й аминокислотой, существует и 22-я — пирролизин (pyrrolysine). Он входит в состав некоторых важных ферментов у организмов, считающихся одними из древнейших на планете, — архей-метаногенов (см. метаногенез). Пирролизин, как и селеноцистеин, кодируется каноническим стоп-кодоном, но другим (UAG), и тоже в сочетании со специальной регуляторной «шпилькой» в некодирующей области гена.
Может быть, эти странные неканонические способы кодирования аминокислот помогут пролить свет на тайну происхождения генетического кода. В статье об этом не говорится, но ведь можно предположить, что в ходе эволюции механизмов специфического синтеза полипептидов в РНК-мире строгое и однозначное соответствие между кодонами и аминокислотами сформировалось не сразу, и поначалу весь генетический код держался «на шпильках».
Источник: Anton A. Turanov, Alexey V. Lobanov, Dmitri E. Fomenko, Hilary G. Morrison, Mitchell L. Sogin, Lawrence A. Klobutcher, Dolph L. Hatfield, Vadim N. Gladyshev. Genetic Code Supports Targeted Insertion of Two Amino Acids by One Codon // Science. 2008. V. 323. P. 259–261.
Александр Марков