Куда уходит фосфор
|
Американские ученые, определив качественный и количественный состав фосфорных компонентов морского осадка и планктона, выяснили механизмы осаждения фосфора в природных условиях. Они показали, что фосфор — важнейший элемент жизни — выводится из обращения при участии микроорганизмов. Таким образом, подтвердилась гипотеза о биогенном формировании фосфоритовых месторождений.
Фосфор — один из важнейших «элементов жизни». Вместе с серой, железом и калием его присутствие предопределяет возможность обитания в тех или иных местах живых организмов. Если фосфора в среде мало, то никакой организм расти не сможет; ограничение по фосфору снижает первичную продукцию (см. также Primary production), что означает уменьшение биомассы для всей трофической цепи. Для понимания продукционной возможности среды следует хорошо представлять себе в том числе и фосфорный дебет и кредит, то есть то, как устроен круговорот фосфора в конкретной обстановке. Фосфор поступает в окружающую среду из земных недр с подземными флюидами и вулканической деятельностью. Далее в форме фосфатов (производных фосфорной кислоты) он утилизируется живыми организмами. Фосфор отмершего органического вещества может возвратиться в круговорот, но в конце концов трансформируется в нерастворимый фосфатный осадок. Состав осадков — нерастворимые соли кальция и марганца (апатиты). И можно даже уже не упоминать, что апатиты — это важнейшие полезные ископаемые, обеспечивающие сырьем химическую промышленность и сельское хозяйство.
Развитие биоты в том или ином месте зависит от соотношения скоростей поступления фосфора и его осаждения. Оценить объемы поступления фосфора относительно просто — это поверхностный сток и подземные флюиды. А вот для оценки темпов осаждения фосфора хорошо бы знать участников этого процесса и механизмы осаждения. Нужно подчеркнуть, что, как это ни удивительно, до настоящего времени нет определенного представления о том, как происходит осаждение фосфатов в природе. Теоретически, в природных условиях — при естественном соотношении ионов, анионов, кислотности — осаждения фосфора происходить не должно. Однако очевидно, что оно происходит — но как?
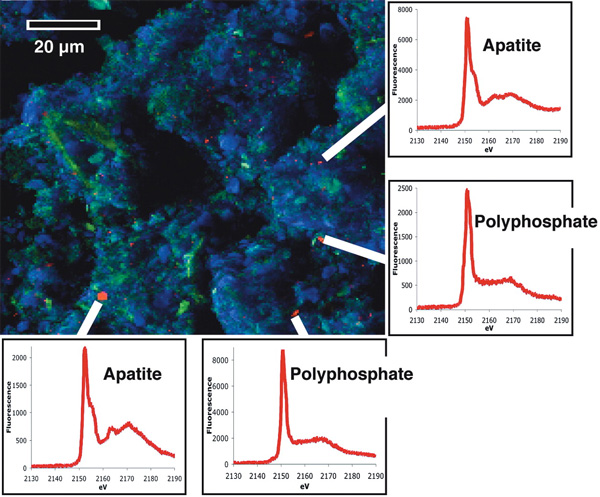
Группа американских ученых из Технологического института Джорджии в Атланте, Университета Южной Каролины в Колумбии, Аргоннской национальной лаборатории (штат Иллинойс) и Океанографического института Скидуэя в Саванне (штат Джорджия) с помощью новейших технологий проследила путь фосфора от поверхности воды до осадка в естественной морской обстановке. На этом пути ученые отметили, как меняется количество фосфора и состав фосфорных соединений и таким образом выявили ключевые точки трансформации фосфора в природе. Методики, которые использовались в их работе, — это высокочувствительная флуоресцентная рентгенография высокого разрешения, позволяющая увидеть (действительно, увидеть в цвете!) картину распределения различных соединений фосфора, а также высокочувствительный электродиализ по фосфору, с помощью которого можно точно оценить количество того или иного фосфорного соединения.
Работа проводилась в канадской провинции Британская Колумбия в морском заливе острова Ванкувер, где были взяты пробы планктона, воды и осадка. Во время отбора проб — в апреле 2007 года — наблюдалось бурное цветение диатомовых водорослей Skeletonema. Эти одноклеточные, как и практически все микроорганизмы, накапливают внутри своих клеток гранулы полифосфатов — так называемые волютиновые гранулы. В этих гранулах скапливается до 30–40% от общего запаса фосфора клетки. Полифосфаты формируются из остатков фосфорной кислоты, которые клетка забирает из окружающей среды с затратой энергии. Клетка использует полифосфаты как запасной источник фосфора для построения энергетических молекул.
Таким образом, первая точка концентрации фосфатов — это гранулы волютина внутри клеток. Исследователи измерили количество полифосфатов в воде и внутри диатомовых водорослей и выяснили, что полифосфаты в морской воде — это в большой степени производные клеточной деятельности. Отмирая и опускаясь на дно, клетки переносят полифосфатные гранулы в осадок. Там клетки распадаются, а гранулы (или зерна) волютина субмикронного размера остаются в осадке. Их и зарегистрировали исследователи с помощью рентгеновской спектроскопии: размер полифосфатных зерен в осадке — 0,5–3 микрона, такого же размера и волютиновые гранулы в живых клетках. Так как полифосфаты очень плохо растворяются в морской воде, обратно в круговорот они уже не возвращаются. Время жизни полифосфатов в осадке, как выяснилось при изучении осадочной толщи, не менее 60 лет.
Тем не менее балансовые расчеты количества полифосфатов в воде, водорослях и на поверхности осадка показали, что некоторое количество полифосфатов всё же куда-то исчезает. Вряд ли эта недостача связана с реутилизацией их живыми клетками. Ведь живые клетки диатомовых могут утилизировать только внутриклеточный полифосфат, но не внеклеточный. Гораздо более вероятно, что полифосфаты в осадке постепенно преобразуются в апатиты. Ученым удалось зарегистрировать в осадке переходные, слабо кристаллизованные частицы апатита. Предположительно, именно гранулы полифосфатов становятся подложкой, или матрицей, на которой начинается кристаллизация апатита, постепенно в геологическом масштабе времени приводящая к образованию скоплений апатитов.
Таким образом, американским ученым удалось в природных условиях показать возможность и масштабность биогенного формирования фосфоритов, а также указать на путь, которым выводится фосфор из планетарного круговорота. По мнению американских специалистов, диатомовые водоросли концентрируют фосфор, переводят его в нерастворимую форму и переносят в осадок. Далее геохимические процессы, идущие в морской воде, постепенно приводят к формированию апатитов. Глобальность процесса подчеркивается всесветным распространением диатомовых водорослей.
|
Нужно, однако, заметить, что диатомовые водоросли появились в ископаемой летописи только в раннем мелу. При этом известны гораздо более древние фосфоритовые месторождения и отложения, например раннекембрийские (540 млн лет) месторождения фосфоритов в озере Хубсугул в Монголии. А ведь диатомей тогда еще не было!
Как следует из списка литературы в конце публикации в Science, специалисты из США незнакомы с исследованиями российских микробиологов, изучавших механизмы биогенного осаждения фосфатов еще 10–15 лет назад. Ученые из институтов микробиологии РАН и палеонтологии РАН в ряде публикаций изложили описанный выше механизм осаждения фосфора при помощи концентрации полифосфата в волютиновых гранулах, но только при участии не диатомей, а цианобактерий. Отличие нового американского исследования от российских состоит в том, что первые изучали свой объект в природе, а вторые — в лабораторных экспериментах. Однако помимо лабораторных экспериментов российские специалисты представили доказательства участия цианобактерий в древнем фосфатоосаждении — это обнаружение фоссилизированных цианобактерий в толщах фосфоритовых отложений Хубсугула.
«Диатомовое» и «цианобактериальное» фосфатонакопление различается своей последней фазой: в первом случае — это медленная геохимическая трансформация полифосфатов в апатит, во втором — изменение кислотности среды и активный транспорт кальция на поверхности клеток. Но в любом случае, участие биоты в круговороте фосфора до сих пор явно недооценивали, особенно если принять во внимание исключительную древность полифосфатных реакций в живых клетках. Ведь даже у древнейших пропионовых бактерий в клетках накапливаются полифосфаты.
Источники:
1) Julia Diaz, Ellery Ingall, Claudia Benitez-Nelson, David Paterson, Martin D. de Jonge, Ian McNulty, Jay A. Brandes. Marine Polyphosphate: A Key Player in Geologic Phosphorus Sequestration // Science. 2 May 2008. V. 320. P. 652–655 [DOI: 10.1126/science.1151751] (in Reports) .
2) Л. М. Герасименко, Г. А. Заварзин, А. Ю. Розанов, Г. Т. Ушатинская. Роль цианобактерий в образовании фосфатных минералов // Журнал общей биологии. 1999. Т. 60. № 4. С.415–430.
3) I. V. Goncharova, L. M. Gerasimenko, G. A. Zavarzin, G. T. Ushatinskaya. Formation of Mineral Phosphate Microtubes in presence of halophilic cyanobacterium Microcoleus chthonoplastes // Current Microbiology. 1993. V. 27. P. 187–190.