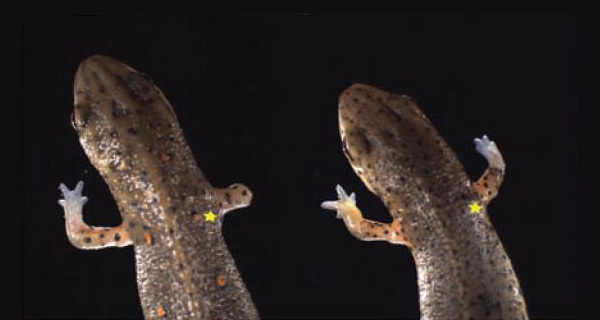
Сделан еще один шаг к пониманию механизмов регенерации
|
Отрезанная конечность у тритона начинает восстанавливаться только в том случае, если в культе остался живой нерв. Механизм, посредством которого нерв «руководит» регенерацией, оставался неизвестным. Британские ученые обнаружили белок, играющий ключевую роль в этом механизме. Достаточно заставить клетки культи производить этот белок, чтобы конечность полностью восстановилась даже в отсутствие живых нервов.
Механизмы регенерации продолжают оставаться во многом загадочными, несмотря на огромный (и вполне оправданный) интерес ученых к этому явлению (см. ссылки внизу). Одной из загадок является роль нервов в процессе восстановления утраченных конечностей. Еще в 1823 году английский врач Твиди Джон Тодд (Tweedy John Todd, 1789–1840) обнаружил, что для восстановления отрезанной лапки у тритона необходимо присутствие живого нерва. Если убить нерв, идущий к конечности от спинного мозга, перерезав его у основания, то регенерация не происходит. В дальнейшем выяснилось, что для нормальной регенерации вовсе не нужно, чтобы нерв функционировал, то есть проводил нервные импульсы или выделял нейромедиаторы. Достаточно, чтобы он «просто был». Как оказалось, присутствие нерва, при выполнении некоторых условий, может стимулировать даже развитие дополнительной конечности («пятой ноги») на месте обычной ранки (см.: Endo et al., 2004. A stepwise model system for limb regeneration). В дальнейшем было показано, что нервы необходимы для многих разновидностей регенерационных процессов как у позвоночных, так и у беспозвоночных.
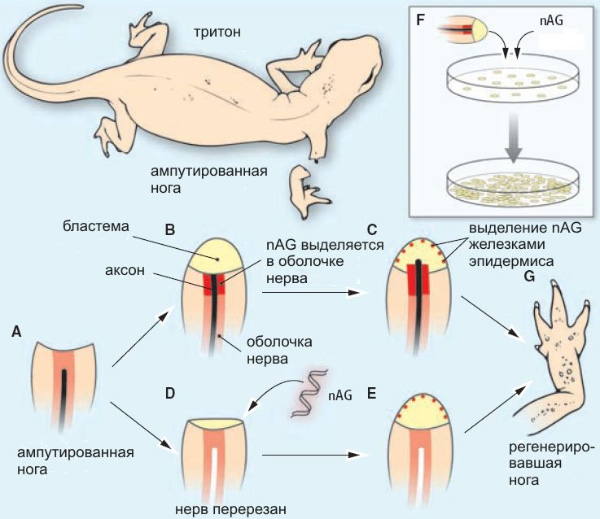
На месте ампутации у тритона сначала образуется так называемая бластема — «холмик» из стволовых клеток, из которого, если всё пойдет нормально, постепенно вырастет новая нога. Бластема образуется даже в отсутствие нерва, но тогда процесс регенерации на этом и останавливается. Если же в культе есть живой нерв (который тоже начинает регенерировать после ампутации), клетки бластемы активно делятся и постепенно формируют заново утраченные части ноги — начиная от проксимальных (ближайших к основанию) и кончая дистальными, то есть пальцами. Интересно, что нерв является необходимым условием только для ранних этапов регенерации (кроме самого раннего — образования бластемы); если конечность уже начала отрастать, то удаление нерва не останавливает этот процесс.
Регенерация конечности идет под управлением нескольких регуляторных белков и белковых комплексов, которые руководят также и процессом образования конечностей в онтогенезе (индивидуальном развитии). «Генетическая программа» регенерации, судя по всему, представляет собой слегка модифицированный фрагмент программы индивидуального развития, которая есть у всех животных (см.: Разгадан механизм регенерации конечностей, «Элементы», 27.11.2006).
Один из важных регуляторов развития конечности — белок Prod 1, располагающийся на поверхности клеток бластемы. Он задает проксимально-дистальный градиент, от которого зависит, какие части растущего зачатка станут плечом, какие предплечьем, а какие — кистью. Чем ближе к основанию конечности, тем выше концентрация белка Prod 1, чем дальше от основания — тем меньше молекул белка можно найти на поверхности клеток развивающегося зачатка. Экспериментально было показано, что если искусственно активизировать синтез белка Prod 1 в дистальной части зачатка, то там, где следовало бы появиться предплечью или кисти, развивается что-то плечеподобное, то есть клетки начинают вести себя так, как если бы они были расположены гораздо ближе к основанию конечности.
Британские биологи предположили, что белок Prod 1, располагающийся на поверхности клеток, играет роль рецептора, и, следовательно, должен существовать лиганд — вещество, которое связывается с этим рецептором (и таким образом клетки бластемы принимают извне некий руководящий сигнал). Этот гипотетический лиганд, очевидно, должен играть важную роль в регуляции регенерационных процессов. Оставалось его найти.
С этой целью ученые исследовали различные вещества, выделяемые клетками регенерирующей конечности, проверяя, не проявляют ли они склонности образовывать прочные комплексы с белком Prod 1. Целенаправленный поиск оказался успешным. Оказалось, что один из секретируемых (выделяемых клетками во внешнюю среду) белков, получивший название nAG, обладает искомым свойством. Этот белок относится к семейству белков AG (anterior gradient), о функциях которого известно довольно мало (в частности, известно, что некоторые AG-белки активно синтезируются в раковых опухолях у человека и грызунов).
Теперь нужно было изучить другие свойства новооткрытого белка. Добавив его в культуру стволовых клеток бластемы, ученые обнаружили, что nAG резко ускоряет их деление. Это означало, что ученые на верном пути и что белок nAG может иметь прямое отношение к регенерации.
На следующем этапе исследований обнаружилась связь белка nAG с нервами. Оказалось, что вскоре после ампутации конечности в дистальной части культи начинается активное производства белка nAG клетками, окружающими регенерирующий нерв (шванновскими клетками). Через некоторое время на поверхности бластемы образуется тонкий эпидермис с желёзками, и в этих желёзках тоже вырабатывается белок nAG.
Если же нерв был перерезан у основания (то есть убит), то после ампутации шванновские клетки не производят белка nAG, а бластема вскоре прекращает свое развитие и не образует железок.
Таким образом, стало ясно, что живой восстанавливающийся нерв необходим для того, чтобы шванновские клетки начали вырабатывать белок nAG. Теперь уже у ученых появились все основания предполагать, что белок nAG играет какую-то роль в передаче «руководящего сигнала» от нерва к клеткам бластемы (а принимается этот сигнал белком Prod 1).
Если бы опыты ставились не на тритонах, а на мышах, то в качестве следующего шага было бы естественно «выключить» ген, кодирующий белок nAG (у мышей его нет, но есть его гомологи — белки AG2 и AG3), и посмотреть, будет ли отрастать отрезанная конечность. Но у мышей конечности, как известно, не отрастают, а у тритонов исследователи пока не умеют так ловко отключать гены. Поэтому исследователи поступили иначе. Сначала они перерезали нескольким тритонам нервы, идущие к правой передней лапе. Потом ампутировали конечность. После этого половине тритонов в культю ввели активно работающий ген белка nAG при помощи метода электропорации. Второй половине тритонов, которая служила контролем, тем же способом вели неработающий фрагмент ДНК.
Результат превзошел все ожидания. У контрольных тритонов, естественно, регенерация не состоялась (поскольку нерв был убит). У основной группы животных, несмотря на отсутствие в культе живого нерва, конечность восстановилась полностью, включая даже пальцы. Синтез белка nAG в шванновских клетках так и не начался, но бластема тем не менее стала быстро делиться и образовала эпидермис с желёзками, и эти желёзки, как и положено, начали производить белок nAG. После этого восстановление конечности шло обычным путем.
|
Таким образом, белок nAG оказался ключевым звеном в передаче сигнала от нерва к клеткам бластемы. Стало ясно, что живой восстанавливающийся нерв нужен для того, чтобы стимулировать производство белка nAG шванновскими клетками. Это стимулирует деление клеток бластемы и образование эпидермиса с желёзками, которые в дальнейшем берут синтез белка nAG на себя.
Данное исследование представляет собой важный шаг в изучении механизмов регенерации, хотя, конечно, до полного понимания этого процесса еще очень далеко (примерно так же, как и до полного понимания механизмов онтогенеза).
Источник: Anoop Kumar, James W. Godwin, Phillip B. Gates, A. Acely Garza-Garcia, Jeremy P. Brockes. Molecular Basis for the Nerve Dependence of Limb Regeneration in an Adult Vertebrate // Science. 2007. V. 318. P. 772–777.