Древняя вирусная инфекция сделала людей беззащитными перед ВИЧ
|
В геномах шимпанзе и гориллы сохранились остатки наследственного материала ретровируса PtERV1, который утратил инфекционность и стал частью обезьяньих геномов 3-4 млн лет назад. Американские ученые «воскресили» древний вирус и показали, что человеческий антивирусный белок TRIM5? обеспечивает мощную защиту против этой доисторической инфекции. Побочным следствием выработки врожденного иммунитета к PtERV1 стала утрата белком TRIM5? способности противостоять некоторым другим ретровирусам, в том числе возбудителю СПИДа.
Геномы многих животных, в том числе приматов, битком набиты так называемыми эндогенными ретровирусами. Это копии геномов вирусов, в прошлом вполне активных и заразных, которые сумели преодолеть «барьер Вейсмана» (Weismann barrier) и проникнуть в половые клетки, но потом в результате мутаций утратили инфекционность и стали частью генома хозяина. Таким образом, эндогенные ретровирусы представляют собой нечто вроде археологической летописи древних вирусных инфекций, с которыми приходилось когда-то сталкиваться данному виду или его предкам.
Молекулярные биологи из нескольких научных учреждений Сиэтла (США, штат Вашингтон) занялись изучением эндогенного ретровируса PtERV1 (Pan troglodytes endogenous retrovirus), сотни копий которого присутствуют в геномах шимпанзе и гориллы. В человеческом геноме этого ретровируса нет. При этом, однако, у человека есть защитный антивирусный белок TRIM5? (компонент системы врожденного иммунитета), который эффективно защищает нас от неопасного для человека ретровируса, отдаленно напоминающего PtERV1 — вируса лейкемии мышей N-MLV.
Интерес к белку TRIM5? — одному из сотен бойцов противовирусного фронта — связан с тем, что у многих приматов (например, у тех же горилл) этот белок обеспечивает эффективную защиту от ВИЧ (HIV-1), а у человека, к несчастью, он совершенно бессилен против этой смертельной инфекции.
Эволюция TRIM5? у приматов протекала очень интенсивно. Этот белок распознает белки оболочки (капсида) ретровируса, прикрепляется к ним и способствует разрушению вирусной частицы. Та часть белка TRIM5?, которая отвечает за узнавание капсидных белков, чаще других попадала под действие отбора и претерпевала быстрые эволюционные изменения (это видно по высокой доле значимых нуклеотидных замен по сравнению с незначимыми или синонимичными). Как минимум один раз это произошло и в человеческой эволюционной линии после ее отделения от линии шимпанзе.
Картина, в общем, ясная: время от времени разные виды приматов сталкивались с какой-нибудь новой опасной ретровирусной инфекцией, и в результате отбирались те варианты TRIM5?, которые обеспечивали наиболее эффективную защиту от данного ретровируса.
Ученые предположили, что человеческий вариант TRIM5?, возможно, был адаптирован для борьбы с древним вирусом PtERV1, который 3-4 млн лет назад поразил предков шимпанзе и горилл и, возможно, представлял угрозу также и для наших предков австралопитеков. Возраст вируса (3-4 млн лет) был установлен по числу различий, накопившихся между разными копиями PtERV1, сохранившимися в геномах шимпанзе и горилл.
Сопоставление этих копий также позволило реконструировать исходную нуклеотидную последовательность вирусного генома, а заодно и доказать, что все копии действительно происходят от единого общего предка, которым когда-то заразились гориллы и шимпанзе.
После этого ученые частично воскресили ископаемый вирус. За основу был взят вирус мышиной лейкемии, часть генома которого была заменена реконструированными последовательностями PtERV1. В частности, заменили ген, кодирующий капсидный белок — тот самый, который распознается защитным белком TRIM5?. Получившийся химерный вирус оказался вполне жизнеспособным (в дальнейшем будем называть его просто вирусом PtERV1, поскольку те части его генома, которые остались от вируса мышиной лейкемии, в контексте данного исследования ни на что не влияют).
Ученые проверяли инфекционность вирусов и эффективность защитных белков на лабораторной культуре почечных фибробластов кошки. Эти клетки, как было показано ранее, не имеют никаких средств защиты от известных ретровирусов. В них, однако, можно внедрять чужеродные гены (например, ген человеческого белка TRIM5?), и тогда клетки могут приобрести устойчивость к тем или иным вирусным инфекциям.
Оказалось, что человеческий TRIM5? весьма эффективно защищает клетки от вируса PtERV1. Вирус заразил 4,1% контрольных «беззащитных» клеток и только 0,03% клеток, вырабатывающих человеческий TRIM5?. Таким образом, люди обладают мощным врожденным иммунитетом к доисторическому вирусу, которого давно нет в природе.
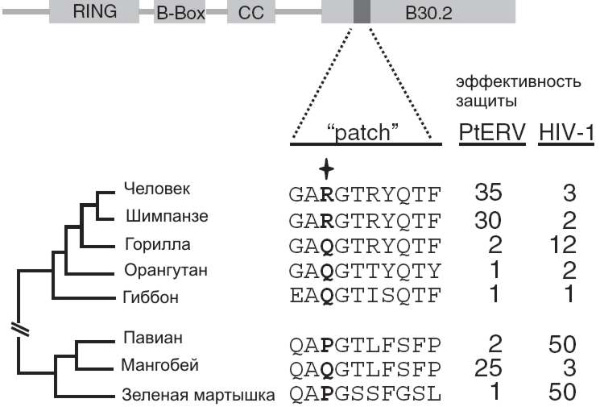
Затем исследователи решили выяснить, какие изменения в белке TRIM5? обеспечили его эффективность по отношению к PtERV1. Ранее было установлено, что важную роль в распознавании белком TRIM5? тех или иных вирусов играет маленький участок белковой молекулы длиной в 10 аминокислот, с 330-й по 339-ю позицию. Внимание исследователей привлекла позиция 332. У предков человекообразных здесь стояла аминокислота глутамин (Q). Это предковое состояние сохранилось у гиббонов, орангутанов и горилл, а у человека и шимпанзе глутамин заменился аргинином (R).
Исследователи модифицировали человеческий белок TRIM5?, заменив аргинин в 332-й позиции «предковым» глутамином. Результат превзошел все ожидания: модифицированный белок стал в 30 раз хуже защищать клетки от ископаемого вируса PtERV1, но зато приобрел способность защищать их от ВИЧ!
Это навело ученых на мысль, что, возможно, белок TRIM5? так устроен, что может эффективно распознавать только один из двух типов ретровирусов: если он в ходе эволюции «настроился» на PtERV1, то не может распознать ВИЧ, и наоборот. Для проверки этого предположения они экспериментально определили эффективность белков TRIM5? разных видов приматов в отношении обоих вирусов. Предположение полностью подтвердилось. Белок TRIM5? человека, шимпанзе и мангобея (Cercocebus atys) эффективен против PtERV1, но бессилен против ВИЧ. У гориллы, павиана (Papio anubis) и зеленой мартышки (Cercopithecus aethiops) тот же белок хорошо защищает от ВИЧ, но не эффективен против PtERV1. Это показывает, что белок TRIM5?, по видимому, не может быть одновременно «настроен» на оба типа вирусов.
|
Возможно, 3-4 млн лет назад среди африканских приматов — предков нынешних горилл, шимпанзе и людей — разразилась эпидемия опасного заболевания, вызываемого вирусом PtERV1. Это способствовало отбору таких мутаций в гене белка TRIM5?, которые повышали устойчивость к инфекции. В частности, у предков людей и шимпанзе глутамин в 332-й позиции заменился аргинином. Гориллы справились с напастью как-то иначе (не следует забывать, что белок TRIM5? — это лишь один из множества барьеров, стоящих на пути вирусных инфекций). Конечно, возможны и другие варианты объяснения обнаруженных фактов, но этот представляется авторам наиболее вероятным. Почему у шимпанзе и горилл вирус сумел проникнуть в геном половых клеток, а у человека нет — на этот вопрос пока нет ответа.
Сегодня, когда вируса PtERV1 больше не существует, зато человечеству угрожает эпидемия ВИЧ, вектор отбора должен был измениться. Вполне можно ожидать, что если бы ВИЧ продолжал косить людей, скажем, еще несколько тысячелетий, злосчастный аргинин снова в результате мутаций и отбора заменился бы глутамином, и другие полезные мутации генов врожденного иммунитета тоже могли бы закрепиться. Впрочем, будем надеяться, что медицина, вооруженная современными генетическими методами, справится с бедой быстрее, чем это сделала бы эволюция.
Источник: Shari M. Kaiser, Harmit S. Malik, Michael Emerman. Restriction of an Extinct Retrovirus by the Human TRIM5? Antiviral Protein // Science. 2007. V. 316. P. 1756-1758.
Александр Марков