Маленькая победа доктора Розенберга
|
Сотрудники американского Национального института рака (НИР, National Cancer Institute, NCI) впервые в мире добились исчезновения крайне агрессивных раковых опухолей с помощью генетически модифицированных иммунных лимфоцитов. В этом клиническом эксперименте участвовали семнадцать больных, из которых выжили только двое. Более того, врачи пока не могут сказать, почему именно у этих пациентов наступила устойчивая ремиссия. Так что руководителю эксперимента Стивену Розенбергу (Steven Rosenberg) и его коллегам пока удалось продемонстрировать, что новая терапия хотя бы в каких-то случаях может работать. Впрочем, они полны оптимизма и рассчитывают в ближайшие годы повысить ее эффективность.
Стивен Розенберг — отнюдь не рядовой борец с раком. С 1974 года он главный хирург НИР и одновременно профессор Медицинского университета американских вооруженных сил (Uniformed Services University of Health Sciences) и Школы медицины и здравоохранения столичного университета Джорджа Вашингтона (George Washington University School of Medicine and Health Sciences). Перечень его наград и почетных степеней с трудом умещается на странице. В 1981-98 годах он неизменно занимал по степени цитируемости первое место в мире среди специалистов по клинической онкологии. В общем, в своей области это звезда первой величины.
Профессор Розенберг стоит у истоков целого направления медицинской онкологии — иммунотерапии рака. Ее цель проста, но труднодостижима: заставить иммунную систему больного как можно активней уничтожать опухолевые клетки. Конечно, иммунная система это делает и без посторонней помощи, особенно на ранних стадиях болезни, но часто ее усилий оказывается недостаточно. Розенберг не первым осознал возможность такого способа борьбы с раком, у него были предшественники, в том числе и в России. Однако он вот уже более тридцати лет с редким упорством ищет пути к его осуществлению на практике, несмотря на многочисленные трудности и неудачи.
Об иммунотерапии рака можно рассказывать долго, это направление давно уже разбилось на несколько ветвей (например, много усилий уделяют разработке противораковых вакцин). Розенберг шел и идет своим путем. Сейчас он стремится внести в наследственный аппарат клеток иммунной системы такие изменения, которые вынудили бы их с удвоенной силой атаковать злокачественные опухоли. Вроде бы ему улыбнулась удача.
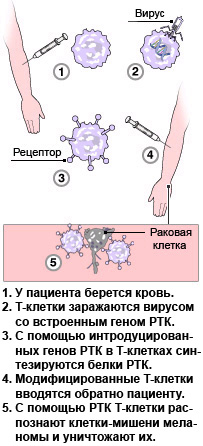
Теперь нам понадобятся кое-какие сведения из области иммунологии. Иммунная система производит много специализированных клеток, которые позволяют нашему организму защищаться от вирусов, бактерий и прочих неприятностей, включая и онкологические заболевания. Среди этих клеток (их называют иммунокомпетентными) особая роль принадлежит цитотоксическим Т-лимфоцитам (или Т-клеткам), они же лимфоциты семейства CD8, они же лимфоциты-киллеры. Их главная задача — распознавать и уничтожать клетки, зараженные вирусами или претерпевшие злокачественное перерождение. На своей наружной мембране они несут особые углеводно-белковые молекулы (гликопротеиды), которые называются рецепторами Т-клеток (РТК). Это своего рода молекулярные щупы, с помощью которых лимфоцит-киллер ищет и находит для себя клетки-мишени.
Механизм такого поиска создан природой в незапамятные времена. Каждый РТК реагируют только на клетки, с поверхности которых выступают определенные конкретные молекулярные маркеры, именуемые антигенами. Их наличие как раз и свидетельствует о том, что данная клетка затронута тем или иным патологическим процессом и потому подлежит уничтожению. Подобных маркеров, конечно, великое множество. Задача иммунной системы состоит в том, чтобы без задержки обнаружить эти антигены и побыстрее начать массовое производство лимфоцитов-киллеров именно с теми РТК, которые ощущают их присутствие. Для любителей точности можно заметить, что РТК выявляют антигены не в изоляции, а в определенном молекулярном окружении, но нам эти детали не понадобятся.
Распознавание антигена — это только прелюдия к уничтожению «вредоносной» клетки. На следующем этапе Т-киллер прикрепляется к ней с помощью особых липких молекул и приступает к выделению специализированных белков, которые проделывают дырки в ее мембране. Через эти поры атакующий лимфоцит впрыскивает в клетку-жертву целый букет ферментов и белков-цитокинов, которые разными способами доводят ее до гибели. Завершив свое черное дело, лимфоцит-киллер отделяется от клетки-мишени и приступает к поиску новых жертв.
|
Теперь вернемся к клиническому эксперименту Розенберга. Его пациенты страдали меланомой — чрезвычайно агрессивной разновидностью рака кожи. Первичные очаги этой опухоли очень быстро дают метастазы во многие органы, особенно в легкие, мозг и печень. Только что возникшая меланома хорошо лечится хирургическим путем, однако в терминальной стадии дает практически стопроцентную смертность.
С далеко зашедшей меланомой пытаются бороться по-всякому, в том числе и посредством иммунотерапии. В последние годы сотрудники НИР достигли кое-каких успехов с помощью метода селекции противоопухолевых лимфоцитов. Работает он следующим образом. Случается так, что организм больного меланомой ухитряется произвести довольно много лимфоцитов-киллеров, реагирующих на клетки этой опухоли. Правда, почти всегда их популяция оказывается недостаточно многочисленной, и больной всё же погибает. Однако можно выделить эти «антимеланомные» лимфоциты из крови больного, размножить их в лаборатории и вновь ввести в кровоток того же самого пациента (чужие лимфоциты, увы, использовать не удается, иммунная система их отторгает). Некоторым пациентам Розенберга такая терапия продлила жизнь.
Но что же делать, если иммунная система больного меланомой вообще не вырабатывает нужных лимфоцитов или производит их в недостаточном количестве? План Розенберга состоял в том, чтобы взять «нейтральные», не обученные борьбе с меланомой Т-лимфоциты и превратить их в снаряды, прицельно бьющие по опухоли. Этого он и добился — с помощью генной инженерии.
У клеток меланомы есть свой специфический антиген, одновременно открытый в 1994 году в США и в Европе. Ученые из НИР, среди которых был и Розенберг, назвали его Melanoma Antigen Recognized by T-cells (антиген меланомы, распознаваемый Т-клетками), сокращенно MART-1, а их бельгийские коллеги выбрали имя Melan-A. Одновременно обе группы идентифицировали и клонировали ген, кодирующий синтез этого белка. Эту информацию группа Розенберга и использовала для дрессировки противоопухолевых лимфоцитов.
Конкретно, было сделано следующее. В геном безвредного ретровируса был встроен ген РТК, способного распознавать меланомный антиген MART-1. Затем медики взяли кровь у семнадцати больных терминальной меланомой, выделили оттуда цитотоксические Т-лимфоциты и инфицировали их этим вирусом-вектором. Лимфоциты, внутрь которых проник вирус, получили в наследство от него данный ген. Потом эти генноинженерные Т-лимфоциты ввели в кровь больных — конечно, каждому свои. Предварительно пациенты получили курс химиотерапии, снижающий риск отторжения модифицированных лимфоцитов. Пациентам также кололи интерлейкин-2, биологически активный полипептид, стимулирующий иммунную систему. Эти процедуры были проделаны около двух лет назад, в 2004 году.
А дальше сработала рука судьбы. На первых трех пациентов экспериментальная терапия не подействовала вовсе. Тогда исследователи усовершенствовали технику выращивания генноинженерных лимфоцитов и ввели их еще четырнадцати пациентам. У них была отмечена активизация антимеланомных Т-лимфоцитов, однако у двенадцати человек она оказалась недостаточной. А вот двоим повезло. У 52-летнего Марка Ориджера до начала лечения были метастазы в области шеи, в подмышечной впадине и в печени. У него исчезли все опухолевые очаги кроме одного в печени, который удалось удалить хирургическим путем. У его тридцатилетнего «товарища по счастью» имелись очаги в легких и в грудной клетке, которые рассосались без оперативного вмешательства. Вот уже полтора года у обоих нет ни малейших клинических симптомов меланомы.
Следует отметить еще некую тонкость. Меланома чаще всего возникает благодаря злокачественному перерождению специализированных клеток кожного эпидермиса — меланоцитов. Эти клетки производят темно-коричневый пигмент меланин, который защищает внутренние слои кожи от солнечного облучения и служит причиной загара. Штука в том, что антиген MART-1 экспрессируется на внешней мембране не только переродившихся, но и обычных меланоцитов. Это означает, что генноинженерные Т-лимфоциты Розенберга должны атаковать и нормальные меланоциты, что и происходит в действительности. В телефонной беседе доктор Розенберг мне рассказал, что у некоторых пациентов наблюдалось полностью безвредное обесцвечивание участков кожи, которое скорее всего как раз и было вызвано этим эффектом. Однако он подчеркнул, что переродившиеся меланоциты производят маркер MART-1 куда интенсивнее здоровых, так что лимфоциты-киллеры со встроенным геном по ним в основном и целятся.
Практически это всё, что известно о новом эксперименте Розенберга. Пока что даже нельзя с уверенностью сказать, что подсаженные Т-лимфоциты действительно обладали антимеланомным действием (такие тесты не проводились), хотя это самое правдоподобное объяснение. Розенберг в интервью CNN сказал, что его группа уже подобрала вирусы, которые могут интродуцировать в Т-лимфоциты гены РТК, способных распознавать антигены клеток рака молочной железы, толстой кишки и еще нескольких распространенных опухолей. Клинические эксперименты с использованием этих вирусов могут начаться уже через несколько месяцев. Так что, возможно, новые сенсации не за горами.
Алексей Левин
Источники:
1) Cancer Regression in Patients After Transfer of Genetically Engineered Lymphocytes // Science Express, 31.08.2006. DOI: 10.1126/science.1129003.
2) New Method of Gene Therapy Alters Immune Cells for Treatment of Advanced Melanoma; Technique May Also Apply to Other Common Cancers — пресс-релиз Национального института рака, 31.08.2006.