Электроны прыгают по водяным островам
|
Биохимики из Университета Дьюка (Дурхам, Северная Каролина, США) выполнили сложнейшие квантово-механические расчеты, которые показали, каким образом даже небольшое количество воды существенно сказывается на взаимодействии белков.
Белки представляют собой длинные цепочки из аминокислот. Но в живых организмах они не вытягиваются по линейке, а сложным образом складываются и только в такой форме проявляют свою биологическую активность. Взаимодействие между белковыми молекулами во многом определяется их формой. Некоторые белки очень точно соответствуют друг другу и могут соединяться, подобно деталям одного механизма. Через такие соединения белки могут обмениваться электронами, что обеспечивает протекание биохимических процессов.
Не всегда один белок подходит к другому идеально, как ключ к замку. В некоторых случаях правильнее говорить о грубо сработанной отмычке. Узкие просветы шириной несколько ангстрем, которые остаются между соединившимися белками, препятствуют прохождению электронов, заставляя их идти «в обход» через точки соприкосновения молекул.
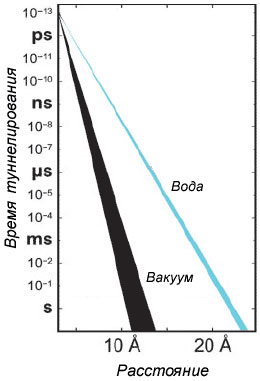
И всё же в некоторых случаях электроны могут преодолеть пропасть благодаря так называемому туннельному эффекту. В квантовой механике так называют способность частиц проникать через потенциальный барьер даже в том случае, когда для этого недостаточно энергии. Просто с некоторой вероятностью электрон оказывается по ту сторону барьера — в нашем случае по ту сторону зазора между белковыми молекулами. Понятно, что чем больше пропасть, тем ниже вероятность того, что электрону удастся через нее перескочить, и тем дольше ему придется ждать счастливой случайности. На рисунке видно (черная полоса), что увеличение дистанции на 1 ангстрем замедляет туннелирование в 40-50 раз. При расстоянии 13-14 ангстрем проход фактически полностью закрывается.
Но всё меняется, когда приходит весн... вода. Химики Цзяньпин Лин (Jianping Lin) и Илья Балабин выполнили под руководством профессора Дэвида Бератана (David Beratan) из Университета Дьюка сложные квантово-механические расчеты и показали, что, если в зазоре между белками присутствует хотя бы несколько молекул H2O, эффективность туннелирования электронов резко возрастает. Например, непреодолимую «всухую» дистанцию 14 ангстрем после «смачивания» электроны пересекают всего за несколько микросекунд (голубая полоса на рисунке).
Молекулы воды, движущиеся в зазоре между белками, служат своеобразными островками, прыгая по которым электроны могут перебраться на другую сторону пропасти. Поскольку каждый такой прыжок намного короче полной ширины зазора, их вероятность оказывается намного выше.
До сих пор считалось, что по мере удаления друг от друга белковых молекул поток электронов между ними убывает экспоненциально. Но так происходило бы только в вакууме. В водной среде всё протекает несколько иначе. На первых ангстремах туннелирование электронов действительно замедляется экспоненциально, но затем, как только в просвет попадет вода, эффективность туннелирования практически перестает зависеть от расстояния. Только на расстояниях свыше примерно 15 ангстрем поток снова начинает падать экспоненциально, сходя на нет около 20 ангстрем.
По словам профессора Бератана, эксперименты, проводившиеся ранее в Нидерландах, а также в Калифорнийском университете в Беркли, уже наводили на мысль об особой роли воды в процессах взаимодействия белков, но только сейчас эти предположения получили теоретическое подтверждение, сообщает Physorg.