
Ученые научились рассчитывать химические связи, используя многомерные пространства
|
Предложен простой и неожиданно очень точный метод расчета электронной структуры молекул, использующий свойства многомерных пространств. Новый подход может привести к бурному прогрессу в квантовой химии.
Человек может легко представить себе даже сложные двумерные фигуры. Для визуализации сложных трехмерных тел требуется уже достаточно развитое воображение, а представлять четырех- и еще более многомерные объекты способны лишь немногие.
В теоретической физике, почти парадоксальным образом, зачастую складывается противоположная ситуация: явления в «очень многомерном» пространстве описать бывает проще, чем в трехмерном. Так, конечно, случается не всегда, но зато когда такой подход срабатывает, он позволяет найти приближенные решения уравнений, которые никак не решались иными способами.
В недавней статье A. A. Svidzinsky, M. O. Scully, D. R. Herschbach, Physical Review Letter, 95, 080401 (17 August 2005) (статья также доступна как physics/0508085) сообщается об очень успешном применении этого подхода к описанию химической связи некоторых простых молекул.
Известно, что уже простейшая двухатомная молекула H2 (т. е. два электрона в поле двух ядер) недоступна точному решению в виде известных функций. Максимум, что здесь можно получить точными расчетами, — это некоторые неравенства (про них мы недавно писали в заметке Решена квантовая задача о стабильности четырех зарядов). Поэтому устройство сложных молекул обычно изучается лишь приближенно с помощью долгих численных расчетов на суперкомпьютерах, и прогресс в этой области физики определяется в основном ростом компьютерных мощностей.
Сейчас же, в рамках нового подхода, вычисление электронного строения и взаимодействия сложных молекул должно занимать гораздо меньше компьютерного времени. Авторы работы доказали, что в пространстве с очень большим числом измерений сложное дифференциальное уравнение можно свести к обычному, алгебраическому. А решение этого уравнения по силам уже наладонному компьютеру и даже некоторым особо продвинутым мобильным телефонам. Сравнение с известными экспериментальными результатами показало хорошую (авторы даже подчеркивают — «неожиданно хорошую») точность нового подхода.
Интересно также и то, что результат очень похож на построенную Нильсом Бором в 1913 году (еще до создания квантовой механики!) полуклассическую теорию химической связи в простых молекулах.
Игорь Иванов

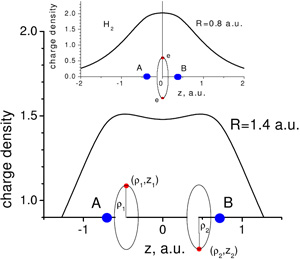

Распределение плотности заряда электронов в молекуле H2 по молекулярной оси z. R — расстояние между ядрами. Окружностями показаны электронные орбиты в модели Бора (изображение с сайта arxiv.org)